Het arrangement Thema: Aquarium h45 is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 21-01-2025 19:30:52
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
StudioVO
Deze module is ontwikkeld door medewerkers van StudioVO.
Fair Use
In de Stercollecties van StudioVO wordt gebruik gemaakt van beeld- en filmmateriaal dat beschikbaar is op internet. Bij het gebruik zijn we uitgegaan van fair use. Meer informatie: Fair use
Mocht u vragen/opmerkingen hebben, neem dan contact op via de helpdesk VO-content.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
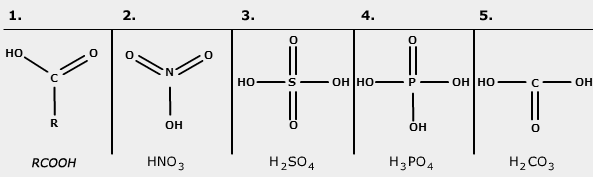
- Dit thema valt onder de arrangeerbare leerlijn van de Stercollecties voor scheikunde voor havo/vwo leerjaar 4 en 5. De volgende onderwerpen worden behandeld: deeltjesmodellen, chemische processen, informatievaardigheden gebruiken. Je kunt aan het eind de namen en formules van verschillende zuren geven.
- Leerniveau
- HAVO 4; HAVO 5;
- Leerinhoud en doelen
- Scheikunde; Reactiviteit;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 18 uur 0 minuten
- Trefwoorden
- arrangeerbaar, chemische processen, deeltjesmodellen, formule, havo/vwo 45, polai, scheikunde, stercollectie, zuren, zuurgraag


















 Demonstratieproef:
Demonstratieproef:

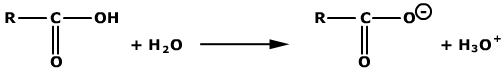
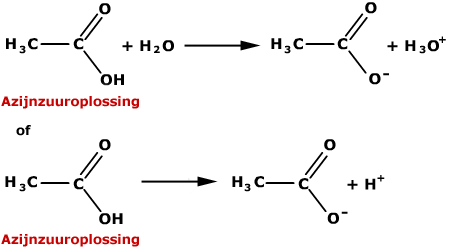





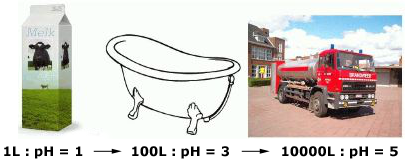

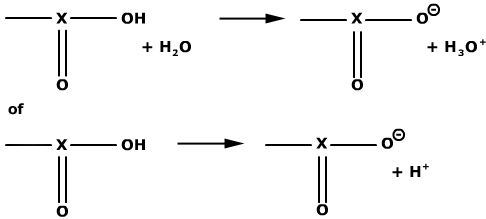







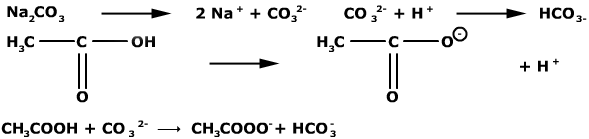


 Dat de pH van de PBS-oplossing constant blijft ondanks het toevoegen van kleine hoeveelheden zuur of base, wil niets anders zeggen dan dat de
Dat de pH van de PBS-oplossing constant blijft ondanks het toevoegen van kleine hoeveelheden zuur of base, wil niets anders zeggen dan dat de