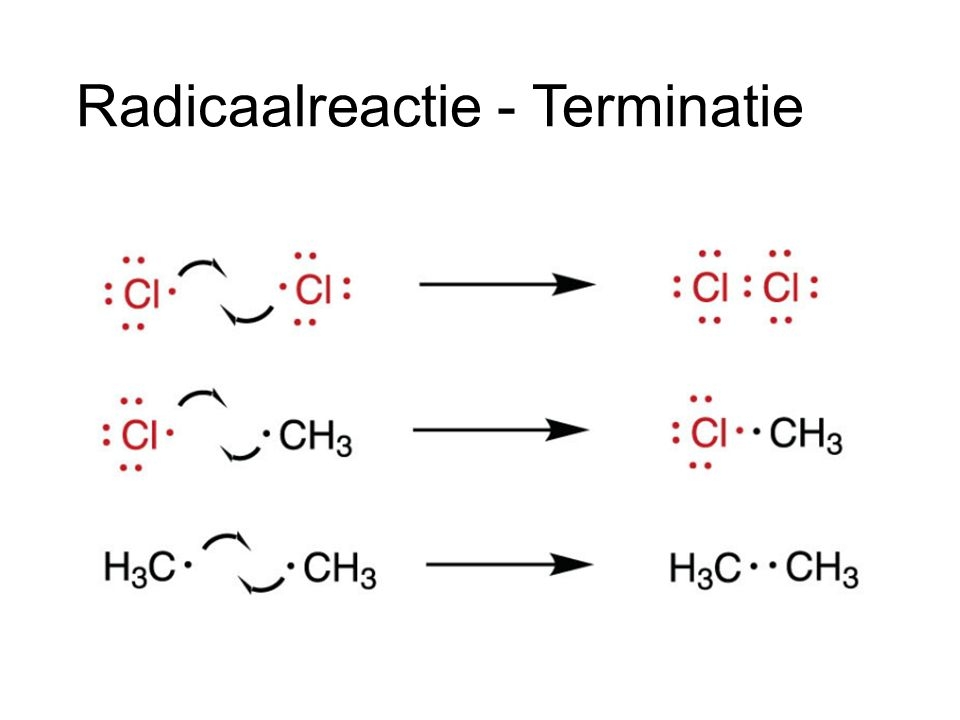
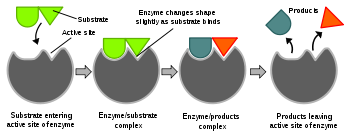
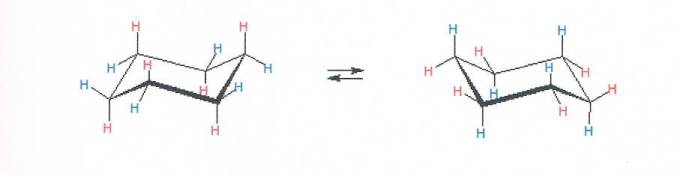
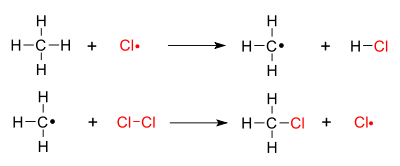Het arrangement Koolstof chemie V5 DNS is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 28-01-2020 12:45:46
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
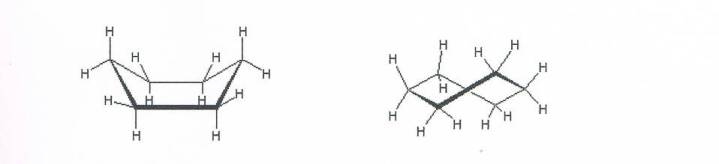
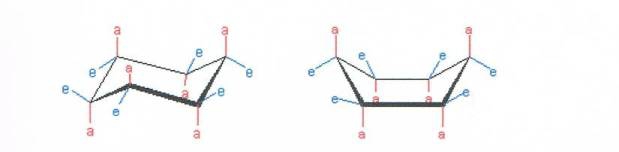
- Online leidraad voor V5 over het onderwerp koolstofchemie. In deze module worden de volgende onderwerpen besproken: Naamgeving, Reacties, Reactie mechanismes, Ruimtelijke bouw, Lewis structuren, Polariteit en Isomerie (Nova H2, H7, H8 en H10). De stof wordt via filmpjes en applets aangeboden met opdrachten die diep leren en onderzoekend leren bevorderen en waarbij leerlingen kunnen oefenen in verschillende contexten.
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Trefwoorden
- flipping your classroom, isomerie, koolstofchemie, lewisstructuren, naamgeving koolstofchemie, onderzoekend leren, polariteit, reactie mechanismes, ruimtelijke bouw
Bronnen
Gebruikte Wikiwijs Arrangementen
Daniëls, Sanne. (z.d.).
Sk-16 Stereochemie - kopie 1
https://maken.wikiwijs.nl/153483/Sk_16_Stereochemie___kopie_1
Scheikunde DNS. (z.d.).
koolstofchemie vwo - kopie 1
https://maken.wikiwijs.nl/152691/koolstofchemie_vwo___kopie_1

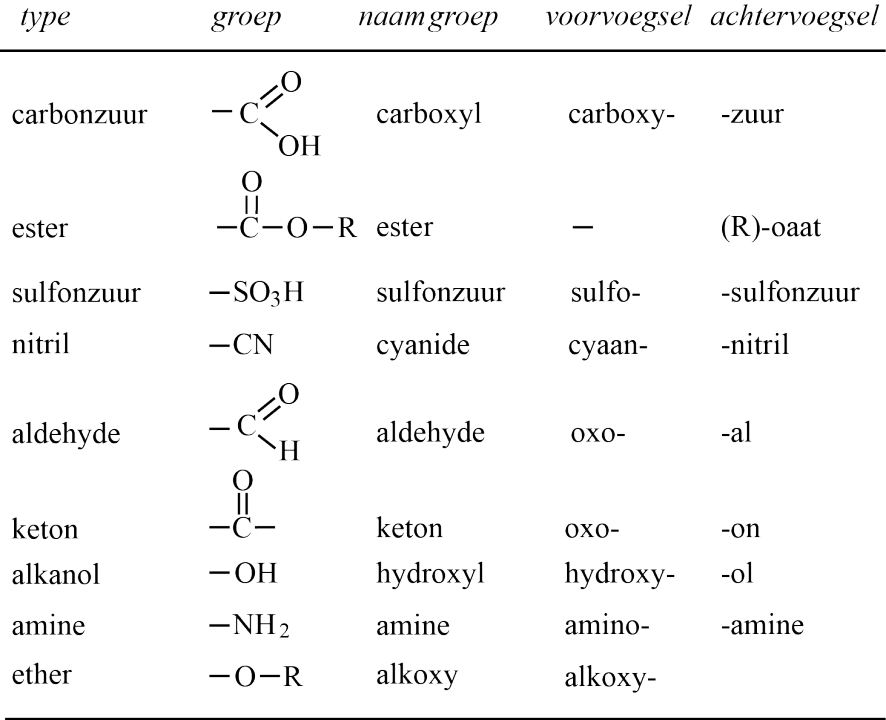
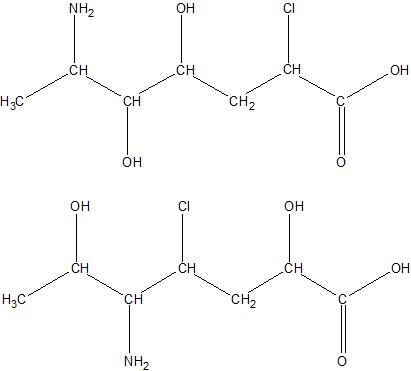
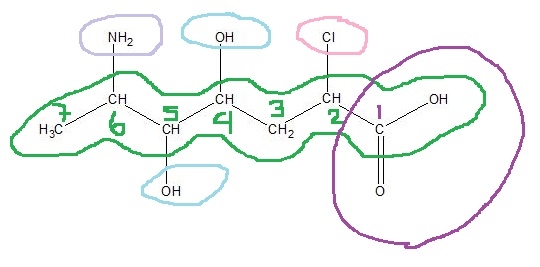
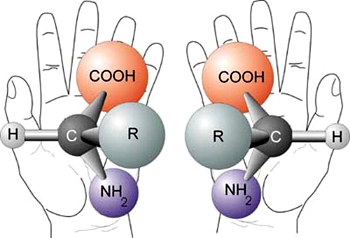

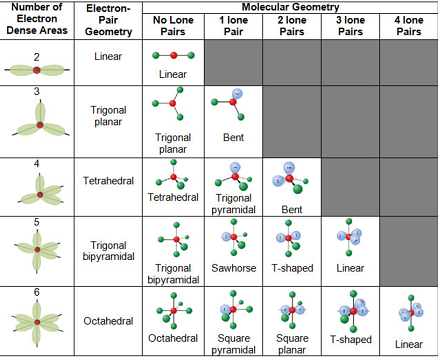
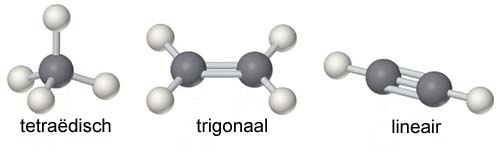
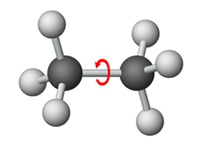

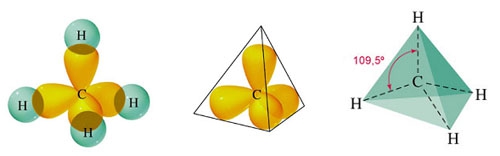
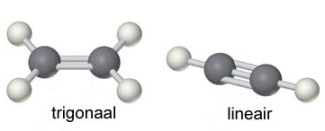


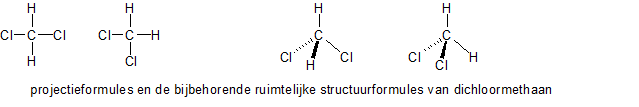

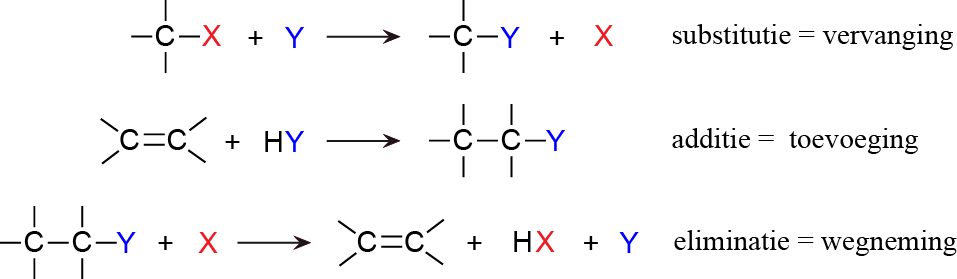
 Eliminatie E1 en E2
Eliminatie E1 en E2