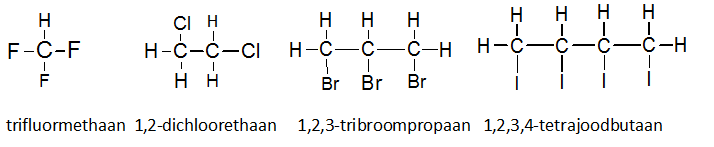
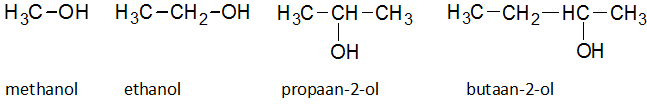
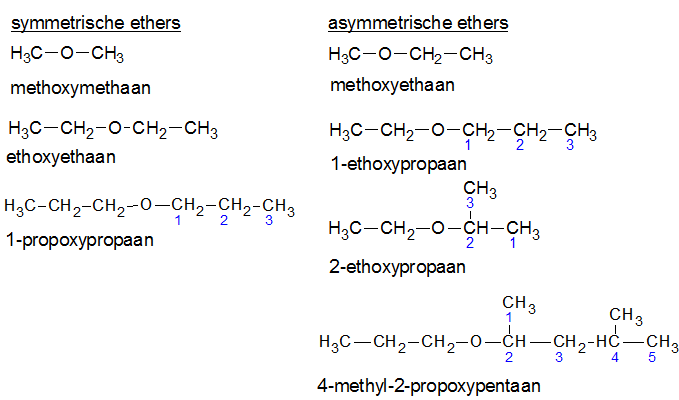
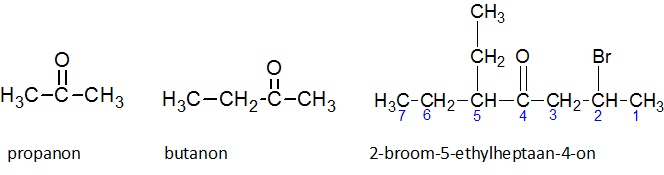
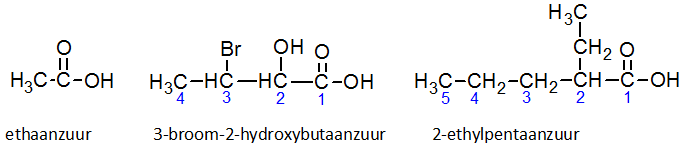
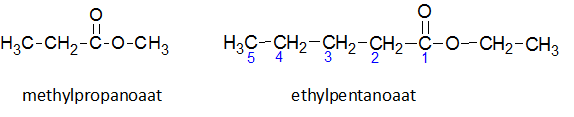
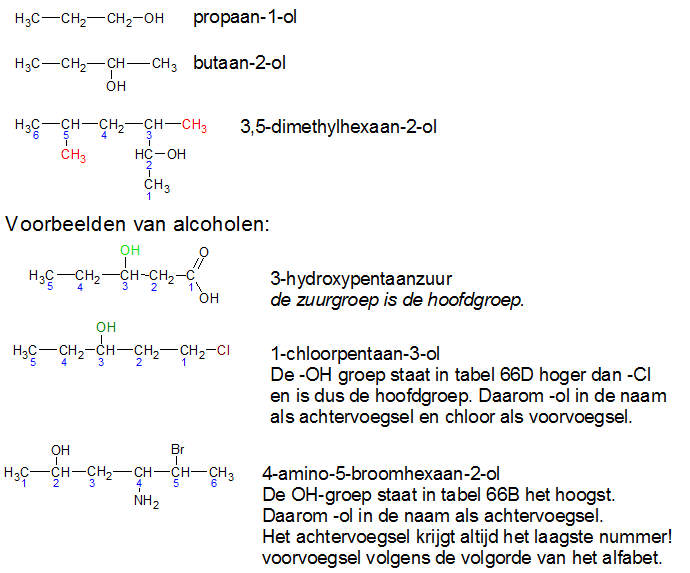
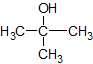
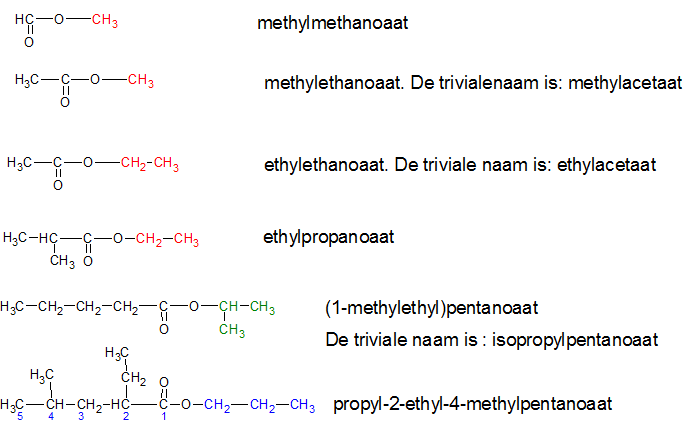
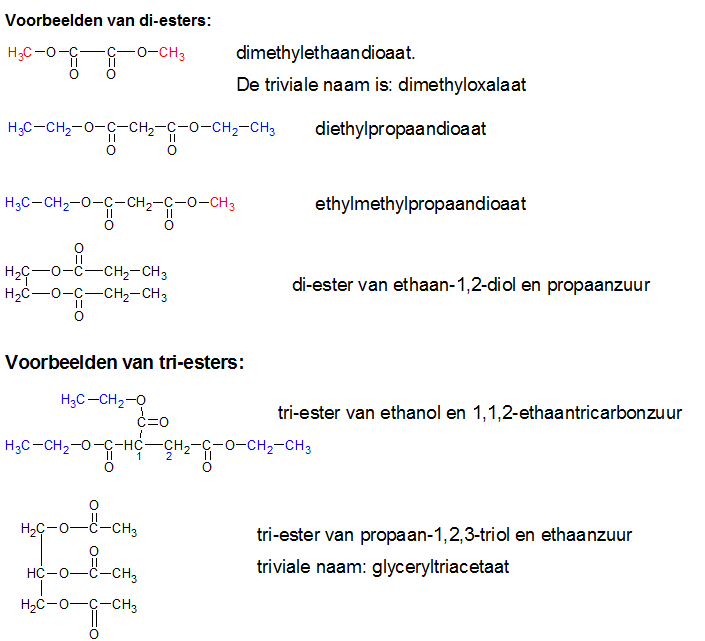
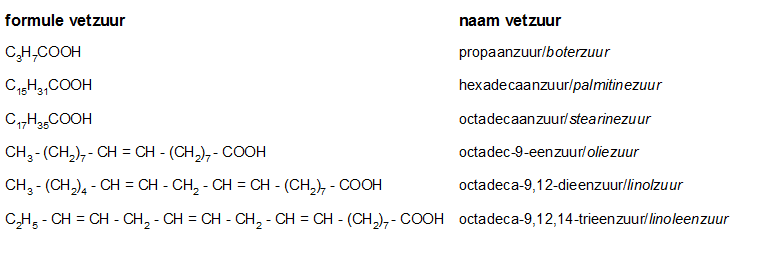
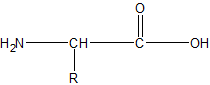
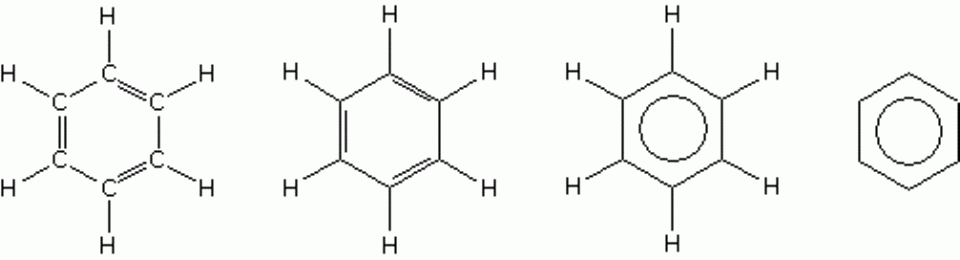
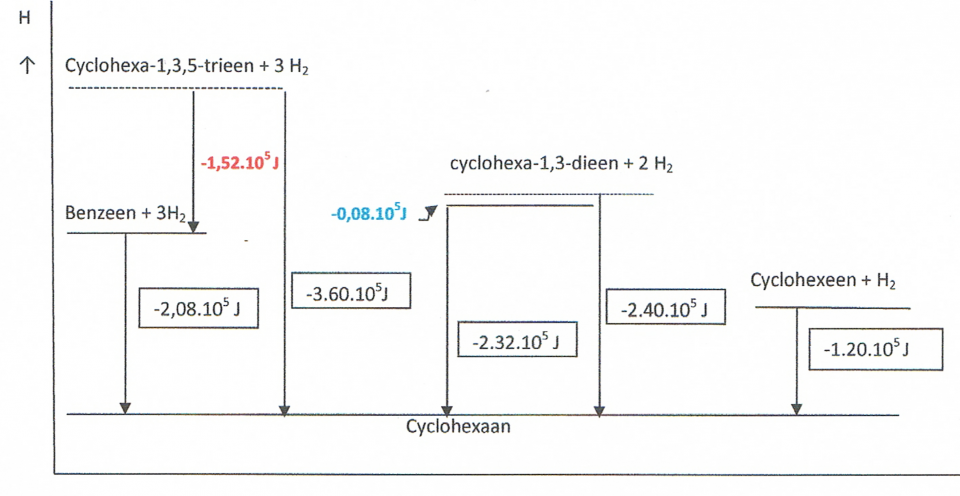
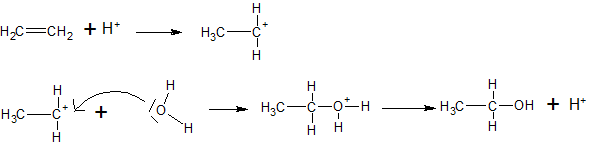
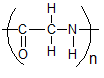
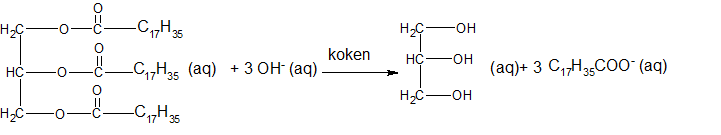
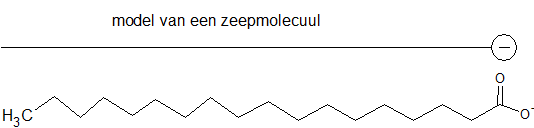
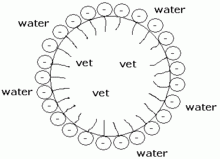
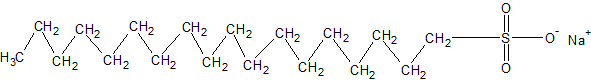
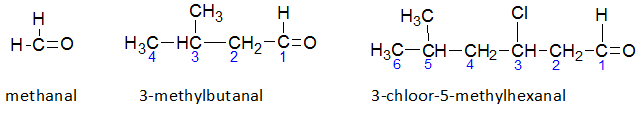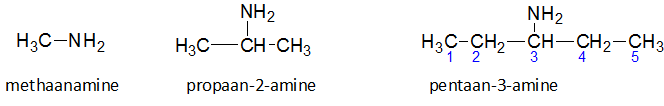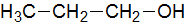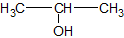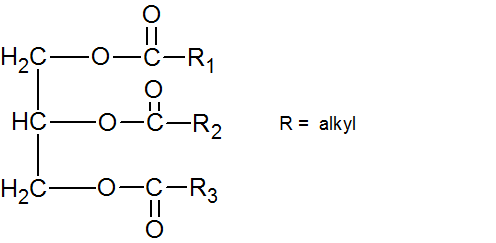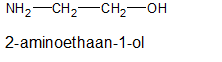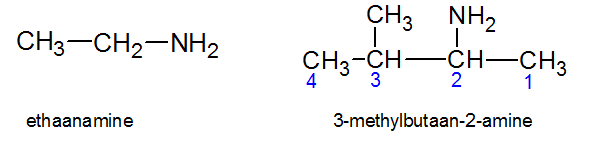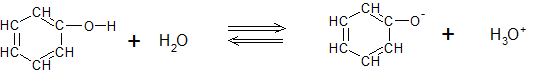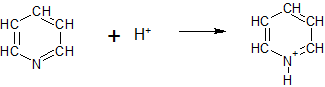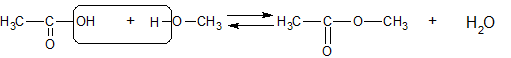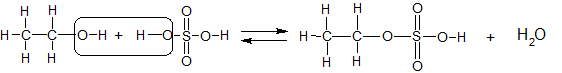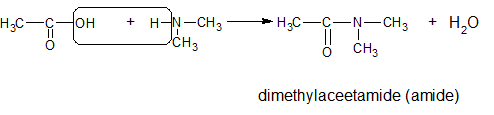Het arrangement Sk-15 Koolstofchemie: stoffen en reacties is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 14-02-2026 09:59:34
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 3.0 Nederland licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Vakinhoudelijk deel van een thema over koolwaterstoffen, omgezet in een Wikiwijs arrangement vanuit een prototype van een kennisbank scheikunde van het voormalige Ruud de Moor Centrum van de OU; zie ook de colofon in het arrangement voor toelichting.
- Leerniveau
- VWO 6;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 0 uur 50 minuten
- Trefwoorden
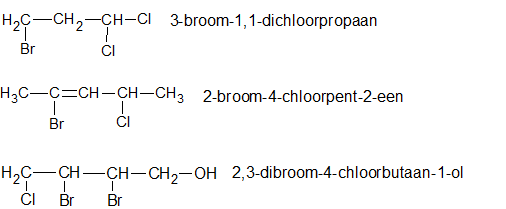
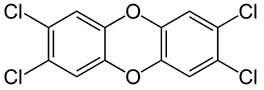
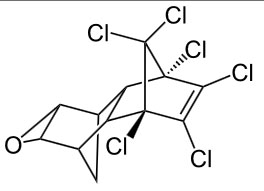
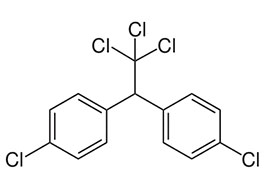
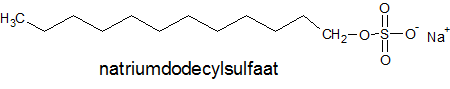
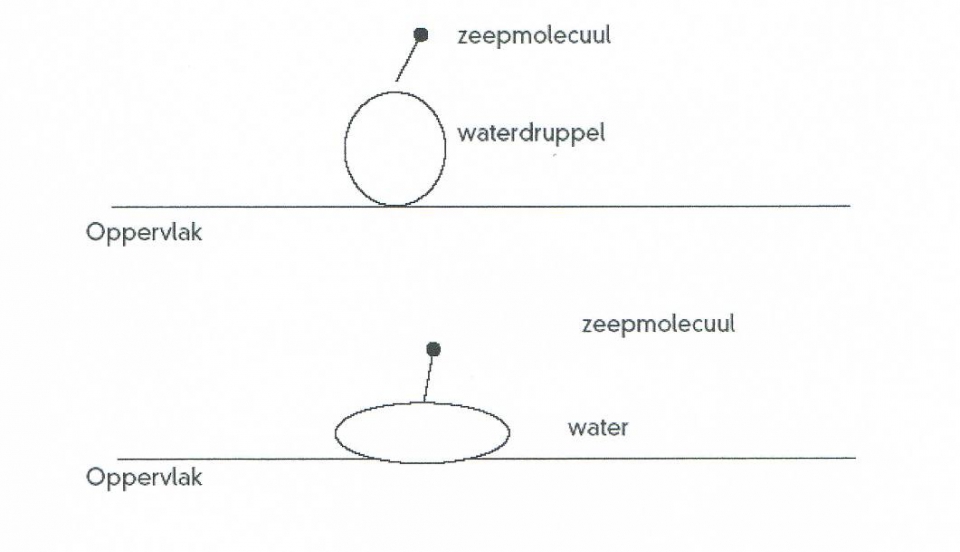
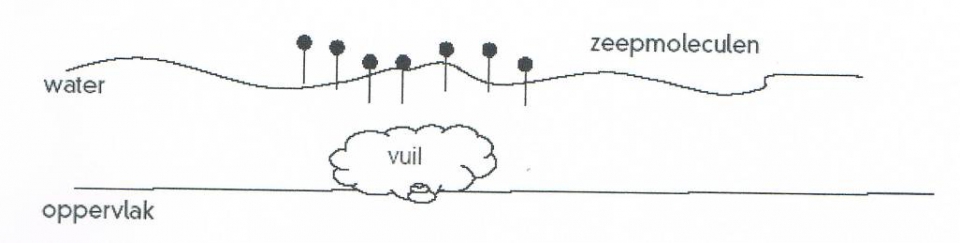
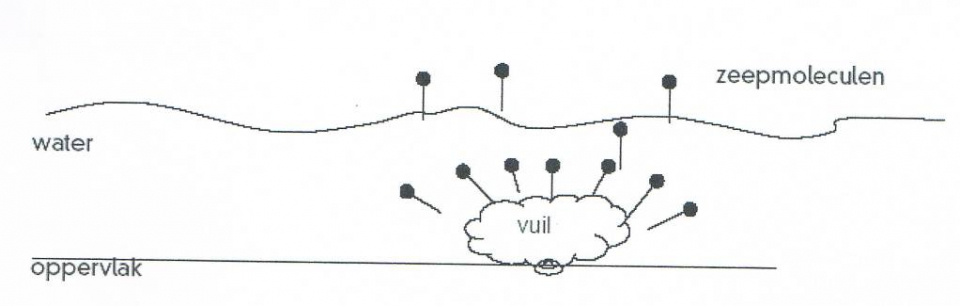
- 1-propanol, aardgas, aardolie, aceton, additiepolymerisatie, additiereactie, additiereacties, alcohol, aldehyde, alifatisch koolwaterstof, alkaanzuur, alkanal, alkanoaat, alkanol, alkanon, alkeen, alkoxyalkaan, alkylalkanoaat, alkylgroep, alkyn, amine, amino, aminogroep, aminozuur, anaeroob, anaeroob metabolisme, andere toepassingen van koolstofverbindingen, apolaire staart, appelzuur, aromatische koolwaterstof, asymmetrische ether, azijnzuur, benzeen, benzenol, boterzuur, carbokation, carbonzuur, cfk, chemie, chemische eigenschap, chloorfluorkoolwaterstof, chloorradicaal, chloorverbinding, citroenzuur, condensatie, condensatiepolymerisatie, condensatiereactie, cyclisch koolwaterstof, cycloalkaan, cycloalkeen, cycloalkyn, cyclohexaan, ddt, detergent, di-ester, dieldrin, dioxine, dipeptide, drievoudige binding, dubbele binding, eiwit, elektronendelokalisatie, endotherm, enthalpiediagram, enthalpieschema, essentieel vetzuur, ester, ethyl, ethylacetaat, exotherm, fehlingreagens, fenol, fluorverbinding, formaldehyde, formaline, freon, fysische eigenschap, geconjugeerd, gehalogeneerd, gehalogeneerd koolwaterstof, gelokaliseerd, glucose, glycerol, glyceryltripalmitaat, glyceryltrostearaat, glycol, grensformule, grensvlakactieve stof, h-brug, halogeen, halogeenverbinding, het maken van stoffen, heteroatoom, hexaan, hoofdgroep, hoofdketen, hydratatie, hydrofiel, hydrofoob, hydrogenering, hydrogeneringsenergie, hydrolysereactie, hydroxy, hyydrolyse, iep, initiatie, ionair, ionair mechanisme, isoelektrisch punt, isomerie, karakteristieke groep, katalysator, kekule, ketenlengte, keton, kloostofverbindingen, koolstof, koolstofchemie, koolstofdioxide, koolstofverbinding, koolwaterstof, koolwaterstoffen, le chatelier, linoleenzuur, linolzuur, london-vanderwaalskracht, macromolecuul, meervoudig onverzadigd, meerwaardig, meerwaardig alcohol, mesomerie, methanol, methyl, micel, mierenzuur, milieuprobleem, molecuulmodel, monomoleculaire nucleofiele substitutie, naamgeving, namen en formules, natuurlijke zeep, nucleofiel, nucleofiele substitutie, numeriek voorvoegsel, oleaat, olie, oliezuur, omega-3-vetzuur, omega-6-vetzuur, onvertakte verbinding, onvertakte verbindingen, onverzadigd, onverzadigd koolwaterstof, onverzadigde koolwaterstoffen, oplosmiddel, oppervlakteactieve stof, oppervlaktespanning, organische chemie, oxaalzuur, ozonlaag, palmitaat, palmitinezuur, pcb, peptide, peptidebinding, pesticide, plaatsnummer, plantaardig, polair, polaire kop, polychloorbifenyl, polyetheen, polymeer, polymerisatie, polypeptide, primair, propagatie, propyl, pvc, pyridine, radicaal, radicaalkettingproces, radicaalmechanisme, radicaalsubstitutie, radicalen, reactie, reactiemechanisme, reacties, reacties van koolstofverbindingen, reactiviteit, redoxreactie, redoxreacties, resonantie, resonantie-enthalpie, resonantieformule, resonantietheorie, ringsysteem, scheikunde, solvatatie, solvateren, stabilisatie, stabilisatie-enthalpie, stearaat, stearinezuur, sterische hindering, stoffen, structuren van koolstofverbindingen, structuurformule, substitutiereactie, substitutiereacties, symmetrische ether, synthetische zeep, tcdd, terminatie, tertiair, toepassingen van koolstofverbindingen, toepassingen van synthetische polymeren, tollensreagens, transvetzuur, triester, triglyceride, triviale naam, vanderwaalskracht, verbranden, verbranding, vergisten, vergisting, vertakte verbinding, vertakte verbindingen, verzadigd koolwaterstof, verzadigd vet, verzadigde koolwaterstoffen, verzadigde vetten, verzepen, vet, vetzuren, voorvoegsel, vuil, wasactieve stof, waswerking, waterstofbrug, zeep, zeepmolecuul, zesring, zwitterion
Bronnen
| Bron | Type |
|---|---|
|
Vorming van esters en hydrolyse van esters. https://youtu.be/6q7gKtpRmds?rel=0 |
Video |
|
Vetten en oliën in ons voedsel. https://youtu.be/YTJSJHgxBJU |
Video |
|
Uitleg over additiereacties. https://youtu.be/QOXmpg1m58I?rel=0 |
Video |
|
Uitleg over polymeren. https://youtu.be/djTYMkIF89I?rel=0 |
Video |
|
Hoe moet je polymeren tekenen? https://youtu.be/u8G3heMitdg?rel=0 |
Video |
|
Substitiereactie van halogenen aan alkanen. https://youtu.be/XBIZZF_TBW0?rel=0 |
Video |
Gebruikte Wikiwijs Arrangementen
Lutgerink, Jan. (2013).
Sk-15 Koolstofchemie: stoffen en reacties
https://maken.wikiwijs.nl/45401/Sk_15_Koolstofchemie__stoffen_en_reacties