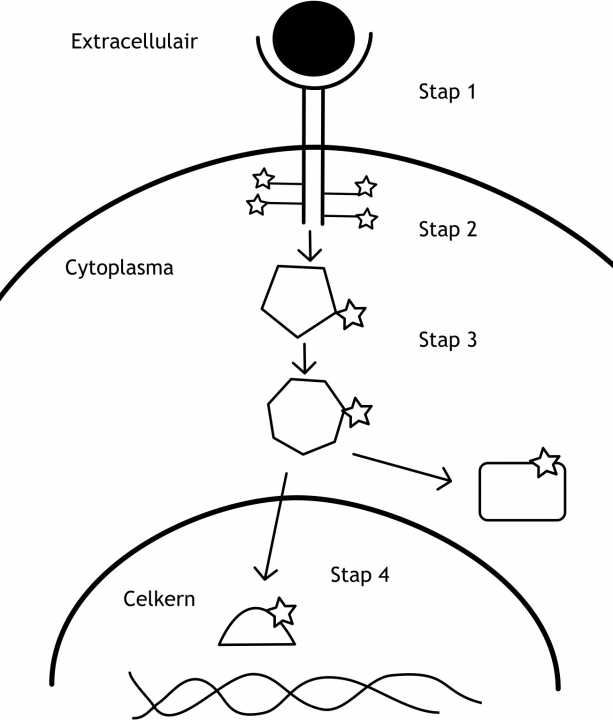
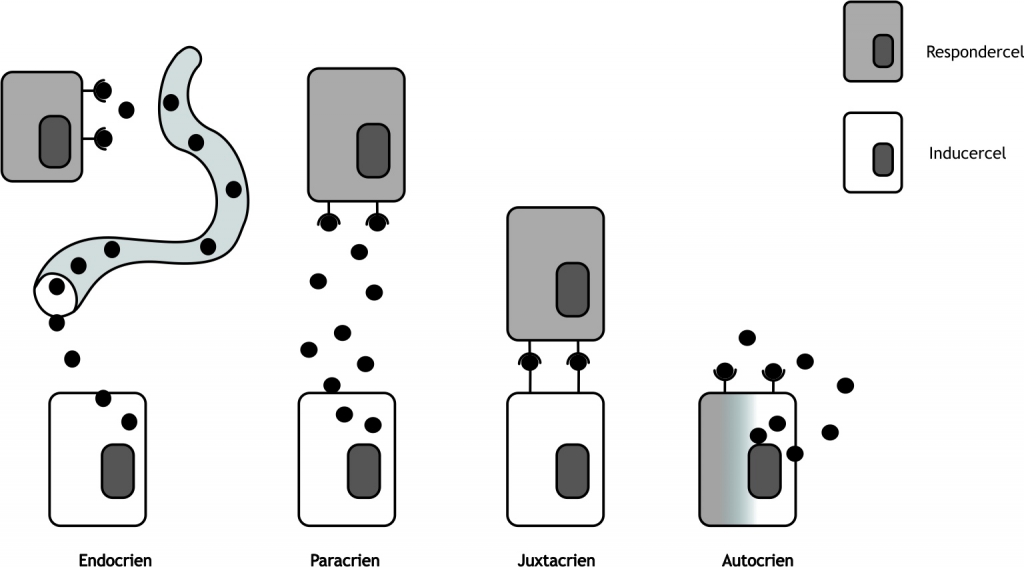
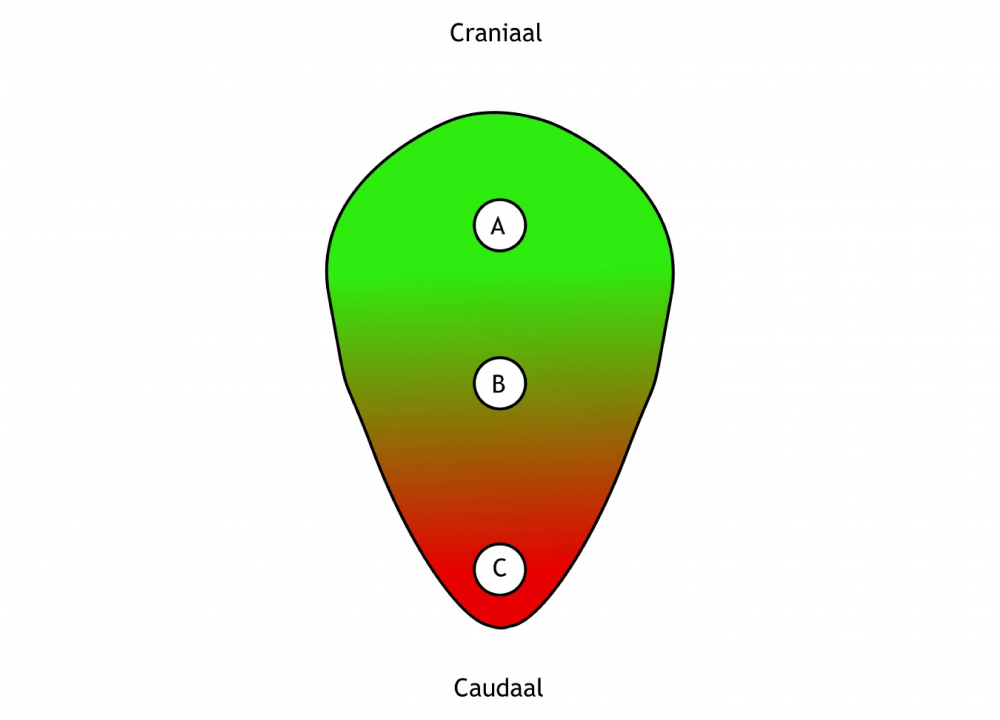
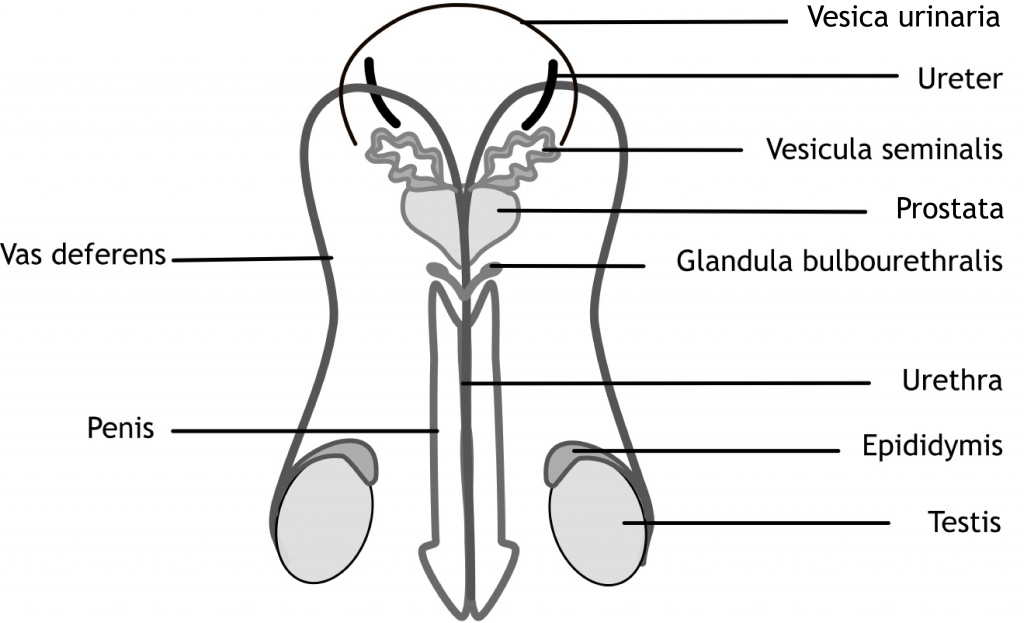
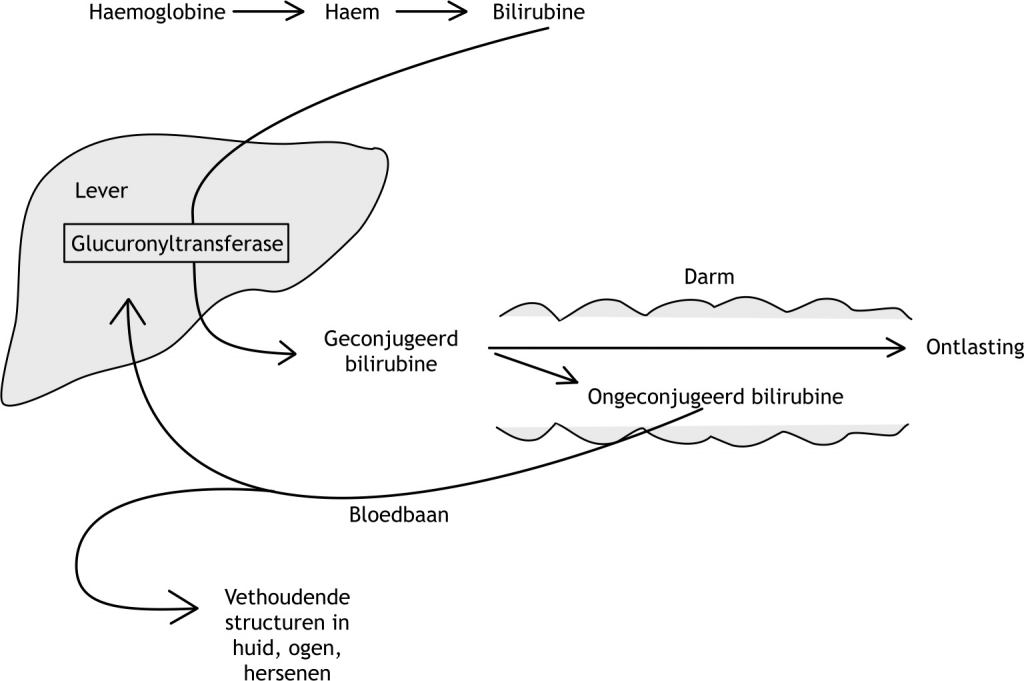
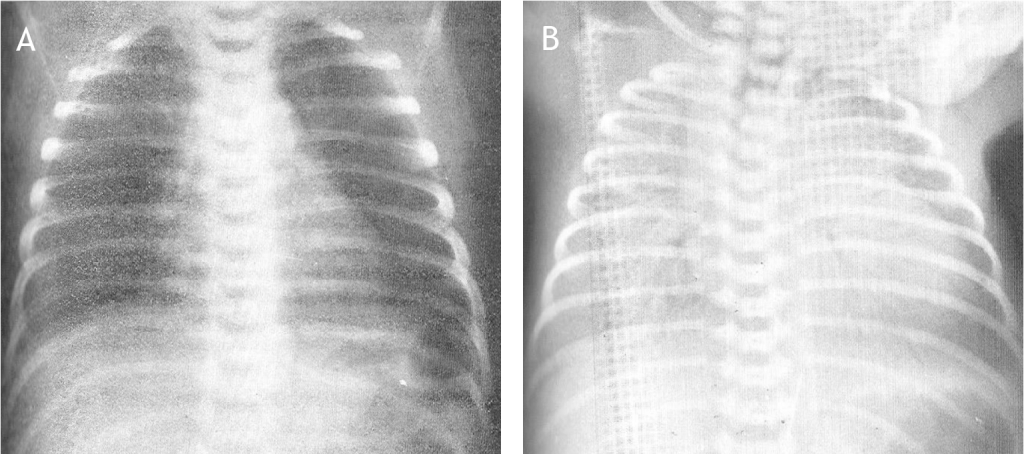
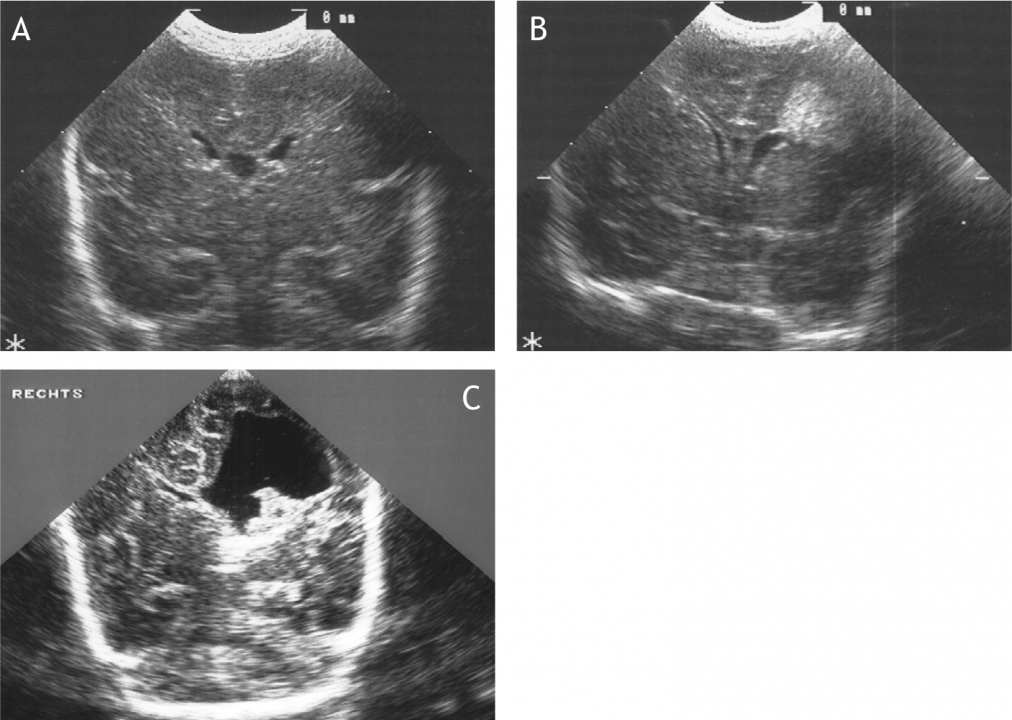
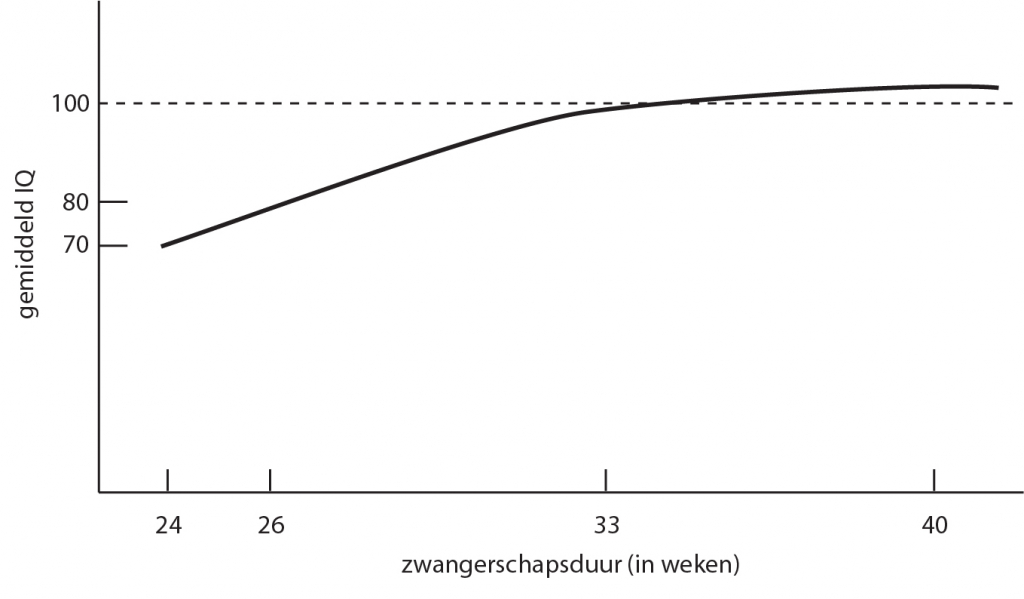
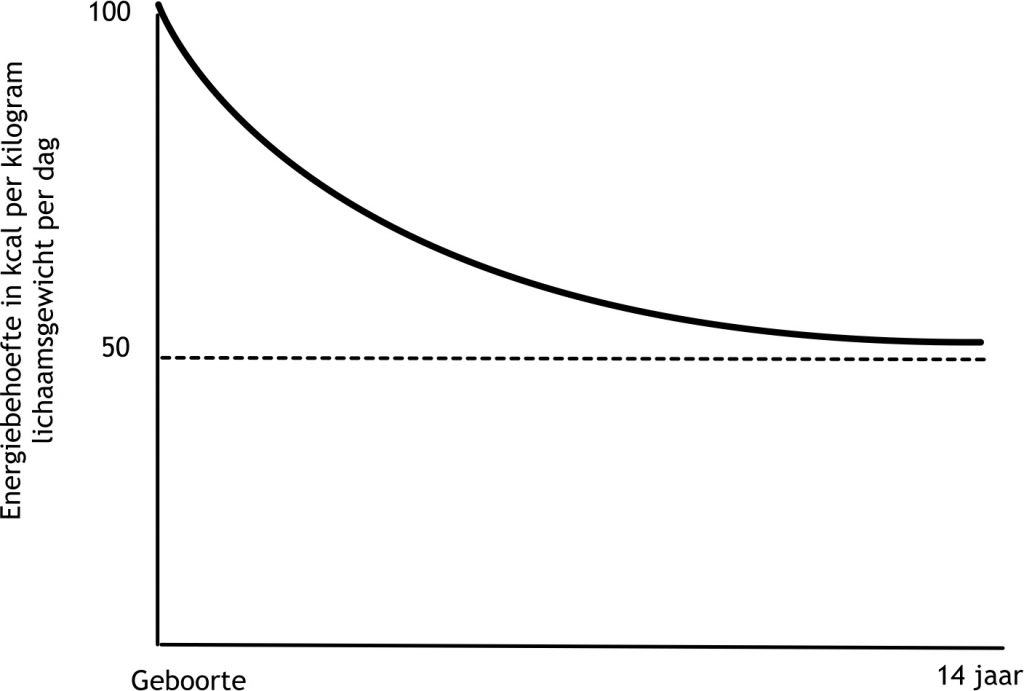
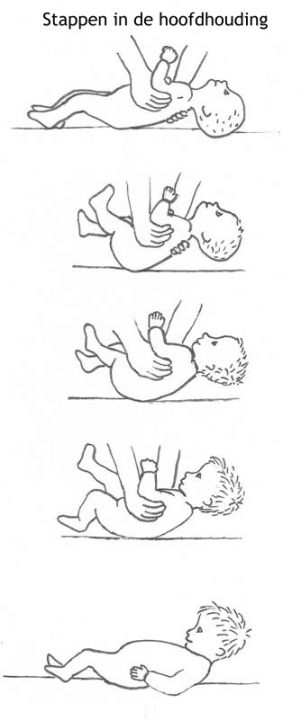
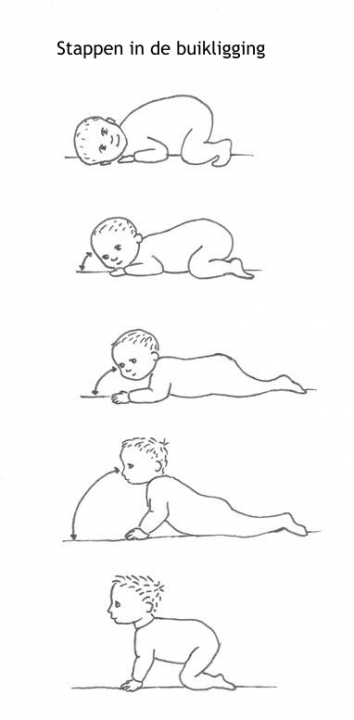
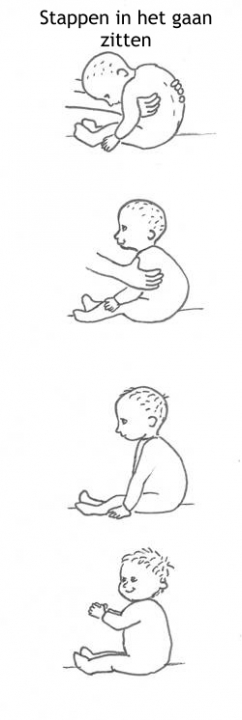
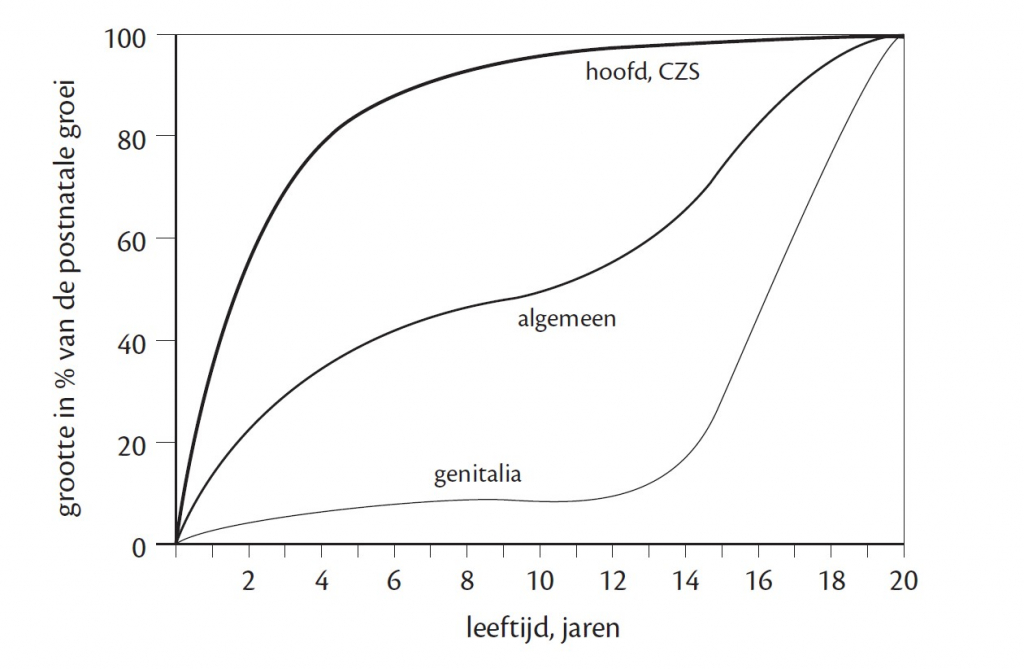
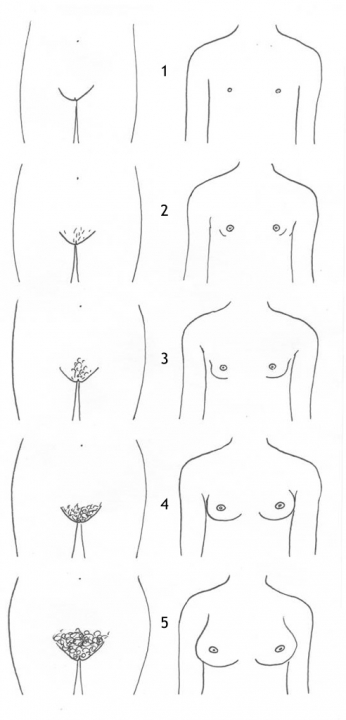
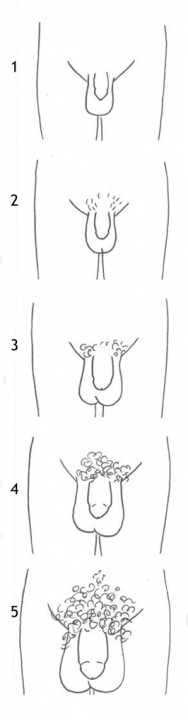
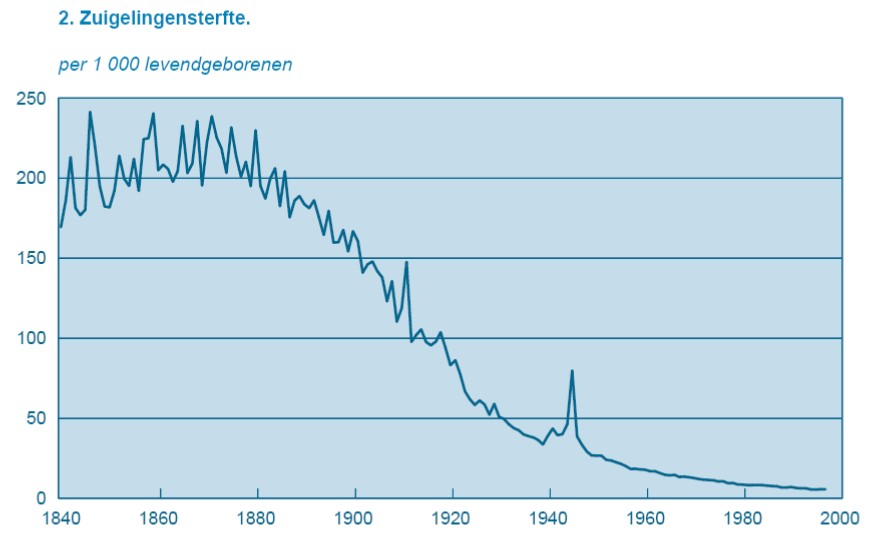
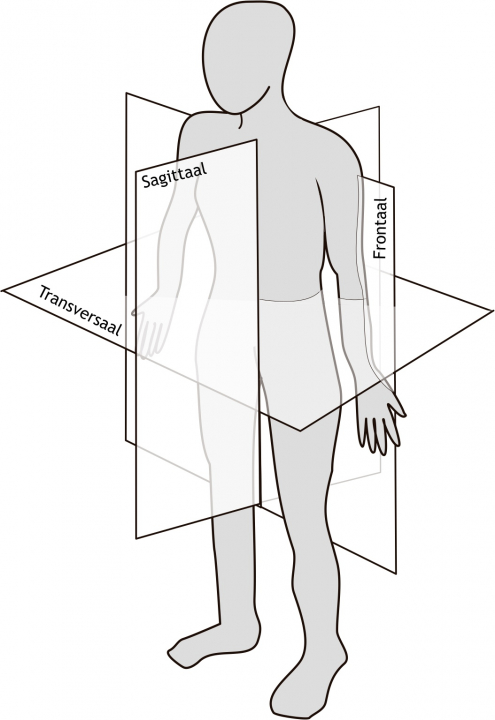
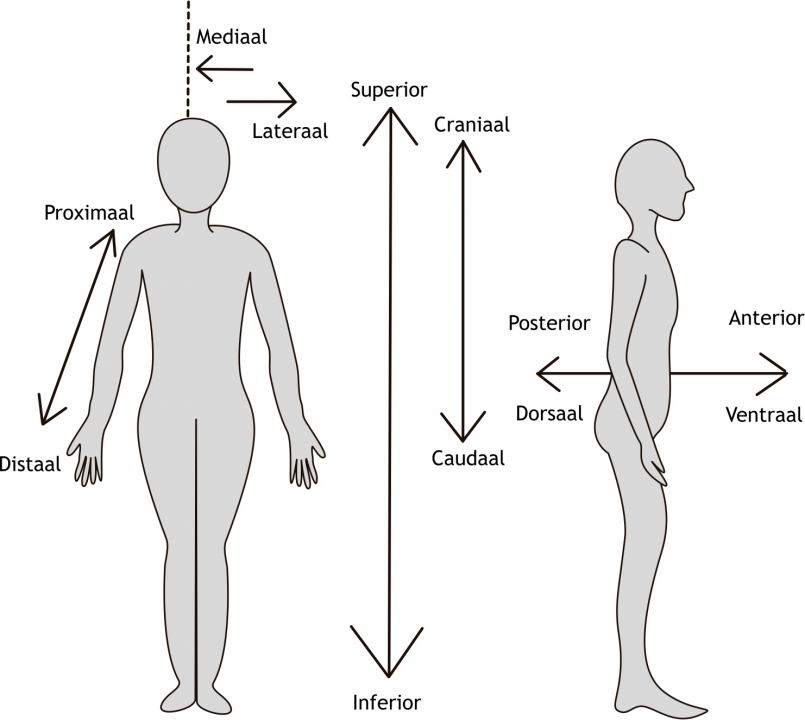
Het arrangement Levenscyclus van de mens is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 06-07-2023 13:13:30
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 4 uur 0 minuten
Gebruikte Wikiwijs Arrangementen
Levenscyclus van de mens. (z.d.).
Hoofdstuk 1 - Inleiding embryogenese: een samenspel tussen cellen en eiwitten
Levenscyclus van de mens. (z.d.).
Hoofdstuk 10 - Postnatale adaptatie
https://maken.wikiwijs.nl/178802/Hoofdstuk_10___Postnatale_adaptatie
Levenscyclus van de mens. (z.d.).
Hoofdstuk 11 - Vroeggeboorte
https://maken.wikiwijs.nl/178803/Hoofdstuk_11___Vroeggeboorte
Levenscyclus van de mens. (z.d.).
Hoofdstuk 12 - Groei en ontwikkeling van het kind
https://maken.wikiwijs.nl/179439/Hoofdstuk_12___Groei_en_ontwikkeling_van_het_kind
Levenscyclus van de mens. (z.d.).
Hoofdstuk 13 - De ontwikkeling van het immuunsysteem
https://maken.wikiwijs.nl/179742/Hoofdstuk_13___De_ontwikkeling_van_het_immuunsysteem
Levenscyclus van de mens. (z.d.).
Hoofdstuk 14 - Ontwikkeling van de geslachtsorganen
https://maken.wikiwijs.nl/179788/Hoofdstuk_14___Ontwikkeling_van_de_geslachtsorganen
Levenscyclus van de mens. (z.d.).
Hoofdstuk 15 - Puberteit
Levenscyclus van de mens. (z.d.).
Hoofdstuk 16 - Gezondheid van kinderen in Nederland
https://maken.wikiwijs.nl/180635/Hoofdstuk_16___Gezondheid_van_kinderen_in_Nederland
Levenscyclus van de mens. (z.d.).
Hoofdstuk 17 - Gezondheid van kinderen wereldwijd
https://maken.wikiwijs.nl/180636/Hoofdstuk_17___Gezondheid_van_kinderen_wereldwijd
Levenscyclus van de mens. (z.d.).
Hoofdstuk 18 - Oorsprong van chronische ziekten in het vroege leven
https://maken.wikiwijs.nl/181804/Hoofdstuk_18___Oorsprong_van_chronische_ziekten_in_het_vroege_leven
Levenscyclus van de mens. (z.d.).
Hoofdstuk 19 - Mechanismen van veroudering
https://maken.wikiwijs.nl/182263/Hoofdstuk_19___Mechanismen_van_veroudering
Levenscyclus van de mens. (z.d.).
Hoofdstuk 2 - Gametogenese
Levenscyclus van de mens. (z.d.).
Hoofdstuk 20 - Atherosclerose en diabetes mellitus
https://maken.wikiwijs.nl/181932/Hoofdstuk_20___Atherosclerose_en_diabetes_mellitus
Levenscyclus van de mens. (z.d.).
Hoofdstuk 21 - Dementie
Levenscyclus van de mens. (z.d.).
Hoofdstuk 3 - Bevruchting en implantatie
https://maken.wikiwijs.nl/174143/Hoofdstuk_3___Bevruchting_en_implantatie
Levenscyclus van de mens. (z.d.).
Hoofdstuk 4 - De tweede ontwikkelingsweek: trofoblast en embryoblast
Levenscyclus van de mens. (z.d.).
Hoofdstuk 5 - De derde ontwikkelingsweek: gastrulatie
https://maken.wikiwijs.nl/174145/Hoofdstuk_5___De_derde_ontwikkelingsweek__gastrulatie
Levenscyclus van de mens. (z.d.).
Hoofdstuk 6 - De vierde tot achtste ontwikkelingsweek: differentiatie van de drie kiemlagen
Levenscyclus van de mens. (z.d.).
Hoofdstuk 7 - Foetale groei
https://maken.wikiwijs.nl/174147/Hoofdstuk_7___Foetale_groei
Levenscyclus van de mens. (z.d.).
Hoofdstuk 8 - Ontwikkeling van vitale organen
https://maken.wikiwijs.nl/176481/Hoofdstuk_8___Ontwikkeling_van_vitale_organen
Levenscyclus van de mens. (z.d.).
Hoofdstuk 9 - Geboorte