Het arrangement Blok: Van groot naar klein - hv123 is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 30-07-2025 15:31:38
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Dit blok hoort bij het thema 'Materie, tijd en ruimte', en is onderdeel van de arrangeerbare leerlijn van de Stercollecties voor Mens en Natuur voor niveau hv123. In dit blok komen verschillende disciplines aan bod, waaronder sterrenkunde, natuurkunde, scheikunde, biologie, geologie en paleontologie. Je krijgt inzicht in de bouw van ons zonnestelsel en de beweging van planeten. Je leert over de waterkringloop en fase-overgangen van stoffen en gaat meer leren over scheikundige begrippen zoals: moleculen, metalen, edelgassen aan de hand van het periodiek systeem. Ten slotte ga je leren over de verbrandingsreactie, dichtheid, atomen, isotopen en kunststoffen. Ook komen er praktische vaardigheden aan bod. Je gaat werken met verhoudingen en rekenen op schaal, een model op schaal maken van het zonnestelsel, je waterafdruk berekenen, een 3D-model maken van een molecuul en van een atoom en dichtheid van een stof berekenen. Wanneer je alle opdrachten hebt doorlopen heb je de keuze uit twee opdrachten om het blok af te sluiten. Opdracht 1 is het maken van een portret van je favoriete element. Opdracht 2 is samen met een klasgenoot een quiz maken over de leerdoelen van dit blok. Veel succes!
- Leerniveau
- VWO 2; HAVO 1; VWO 1; HAVO 3; VWO 3; HAVO 2;
- Leerinhoud en doelen
- Energie; Materie; Mens en natuur; Scheikunde; Bouw van de materie; Stoffen en eigenschappen van stoffen; Kennis en technologie; Ontstaan van heelal, aarde en leven; Natuurkunde; Verbranden en verwarmen;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 10 uur 0 minuten
- Trefwoorden
- arrangeerbaar, hv123, materie tijd en ruimte, mens en natuur, moleculen, periodiek systeem, stercollectie, van groot naar klein, waterkringloop, zonnestelsel
Gebruikte Wikiwijs Arrangementen
VO-content - Gereedschapskist. (2019).
Gereedschapskist activerende werkvormen
https://maken.wikiwijs.nl/105906/Gereedschapskist_activerende_werkvormen














 In het thema 'Kijken naar kenmerken' (het blok: 'Stoffen om je heen') heb je al gekeken naar stoffen en de bijbehorende eigenschappen.
In het thema 'Kijken naar kenmerken' (het blok: 'Stoffen om je heen') heb je al gekeken naar stoffen en de bijbehorende eigenschappen.


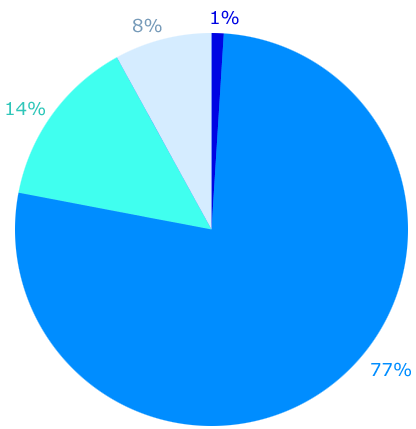 Als je een flesje met 0,5 liter cola drinkt, verbruik je eigenlijk 36 liter water!
Als je een flesje met 0,5 liter cola drinkt, verbruik je eigenlijk 36 liter water!



 Om serieus water te besparen, is dus meer nodig dan korter douchen.
Om serieus water te besparen, is dus meer nodig dan korter douchen. Overal om ons heen zijn stoffen. Stoffen noem je ook wel materie.
Overal om ons heen zijn stoffen. Stoffen noem je ook wel materie.

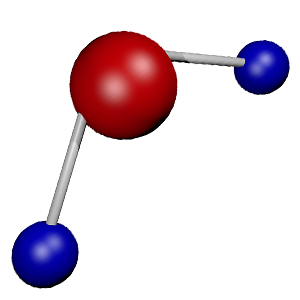





 De dichtheid is meestal aangegeven bij kamertemperatuur (20 graden Celsius). Dit komt omdat de dichtheid afhankelijk is van de temperatuur. Als de temperatuur toeneemt dan zullen de moleculen sneller bewegen.
De dichtheid is meestal aangegeven bij kamertemperatuur (20 graden Celsius). Dit komt omdat de dichtheid afhankelijk is van de temperatuur. Als de temperatuur toeneemt dan zullen de moleculen sneller bewegen.
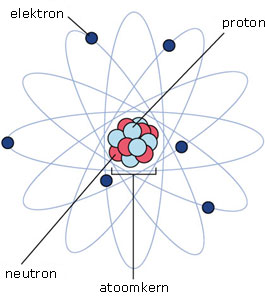 In de vorige stappen heb je gekeken naar de bouw van moleculen. Moleculen bestaan uit nog kleinere deeltjes.
In de vorige stappen heb je gekeken naar de bouw van moleculen. Moleculen bestaan uit nog kleinere deeltjes.
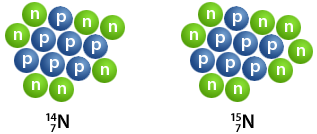






 In dit blok heb je veel verschillende stoffen leren kennen; stoffen die bestaan uit een enkel atoom of meerdere atomen samen in een molecuul. Ook heb je kleine en grote moleculen gezien.
In dit blok heb je veel verschillende stoffen leren kennen; stoffen die bestaan uit een enkel atoom of meerdere atomen samen in een molecuul. Ook heb je kleine en grote moleculen gezien.


