Het arrangement Hoofdstuk 5: Water (M&T_TL) is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteurs
- Laatst gewijzigd
- 2020-03-19 08:40:34
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Een webquest waarin de leerlingen alles leren over hoofdstuk 5.
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
Bronnen
| Bron | Type |
|---|---|
|
Faseovergangen https://www.youtube.com/watch?v=oLQmWfCiH4k |
Video |
|
Waterkringloop https://www.schooltv.nl/video/de-waterkringloop-van-regenwolk-naar-zee-en-weer-terug/#q=waterkringloop |
Video |
|
Zeewater indampen https://www.schooltv.nl/video/zout-uit-de-zee-gemaakt-uit-zeewater/ |
Video |
|
Adsorberen met actieve koolstof https://www.schooltv.nl/video/adsorberen-een-heel-voetbalveld-in-een-paar-korrels-actieve-kool/ |
Video |
|
Grote of kleine dichtheid https://schooltv.nl/item/dichtheid-kleine-of-grote-dichtheid/ |
Video |
|
https://www.educreations.com/lesson/embed/49845383/?ref=embed https://www.educreations.com/lesson/embed/49845383/?ref=embed |
Video |
|
Hoe maak je drinkwater? https://www.schooltv.nl/video/drinkwater-van-de-natuur-naar-de-kraan/ |
Video |
Gebruikte Wikiwijs Arrangementen
Oosterhoff, Matthijs. (z.d.).
Hoofdstuk 5: Water (M&T_TL)
https://maken.wikiwijs.nl/120540/Hoofdstuk_5__Water__M_T_TL_


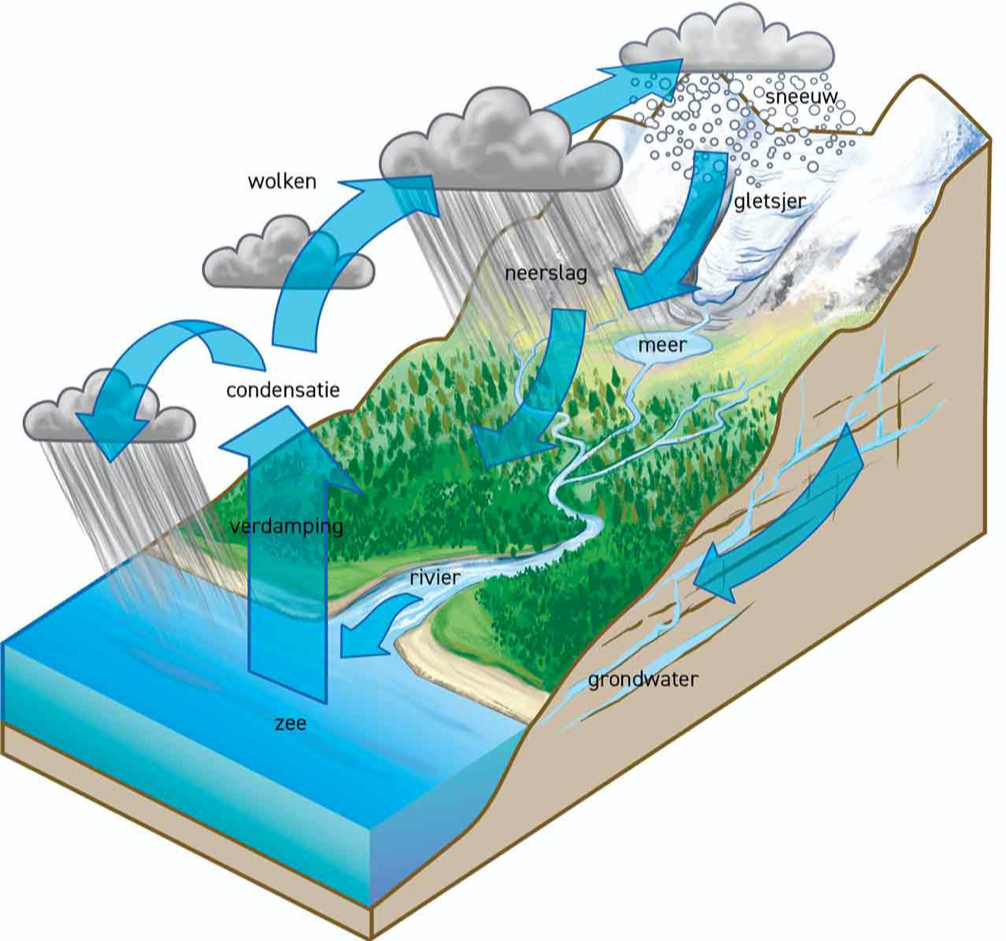
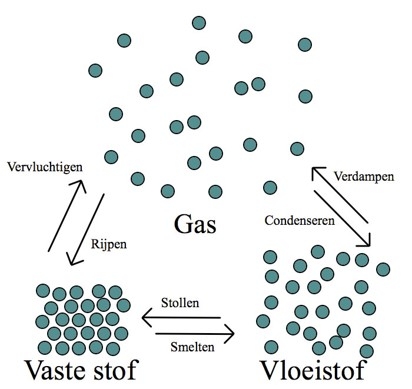
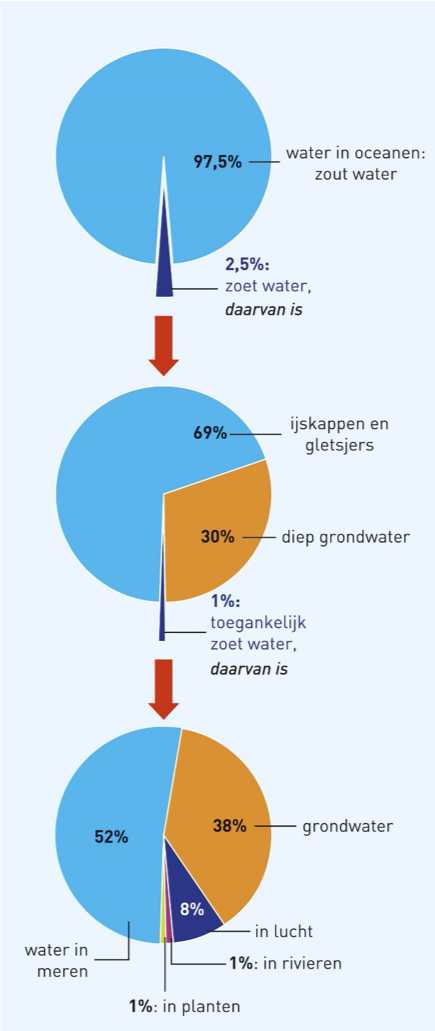
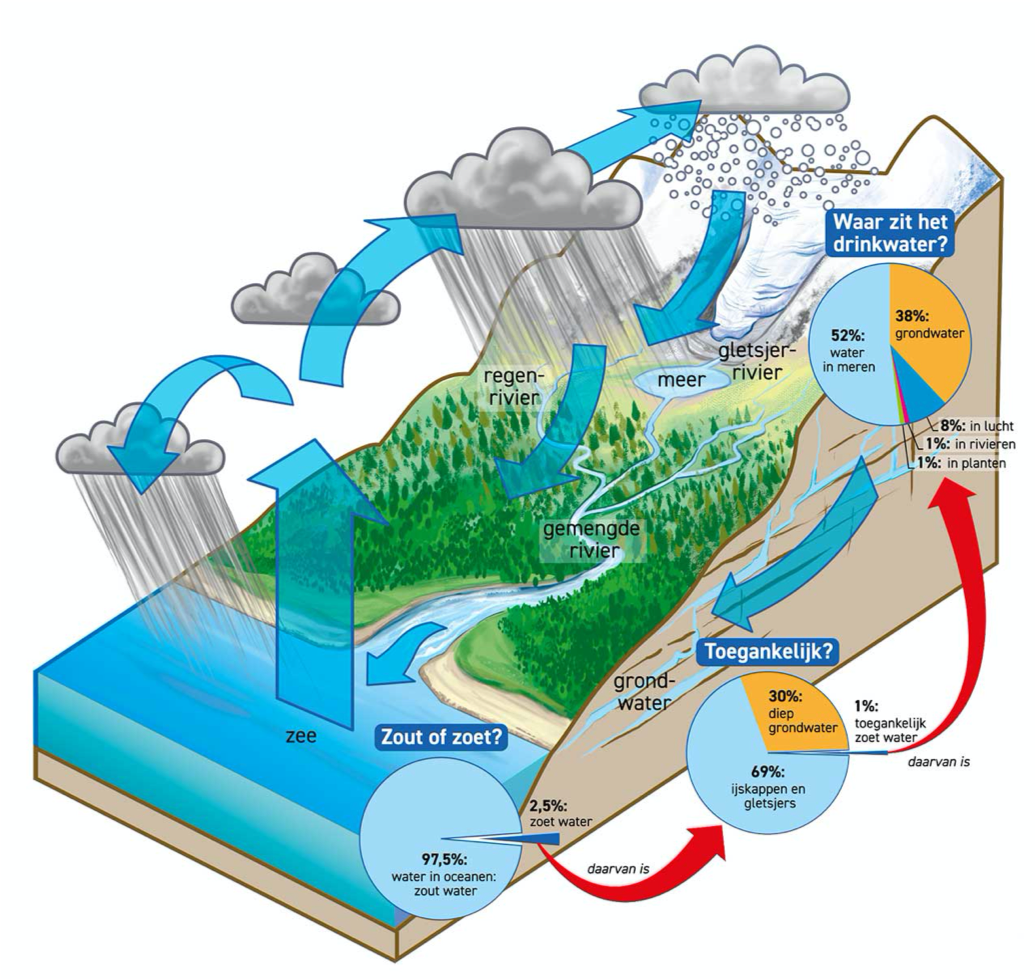
 Waterkringloop
Waterkringloop

 Hiernaast zie je een voorbeeld van een mengsel. In het linkerbekerglas zit water met daarin modderdeeltjes. Het is water uit een sloot. Het water is troebel. Troebel betekend dat je een vloeistof hebt met vaste deeltjes hebt die niet oplossen in de vloeistof. In dit voorbeeld is de vloeistof: water en de vaste deeltjes zijn de modderdeeltjes. Je noemt zo'n mengsel een suspensie. Slootwater is dus een mengsel.
Hiernaast zie je een voorbeeld van een mengsel. In het linkerbekerglas zit water met daarin modderdeeltjes. Het is water uit een sloot. Het water is troebel. Troebel betekend dat je een vloeistof hebt met vaste deeltjes hebt die niet oplossen in de vloeistof. In dit voorbeeld is de vloeistof: water en de vaste deeltjes zijn de modderdeeltjes. Je noemt zo'n mengsel een suspensie. Slootwater is dus een mengsel.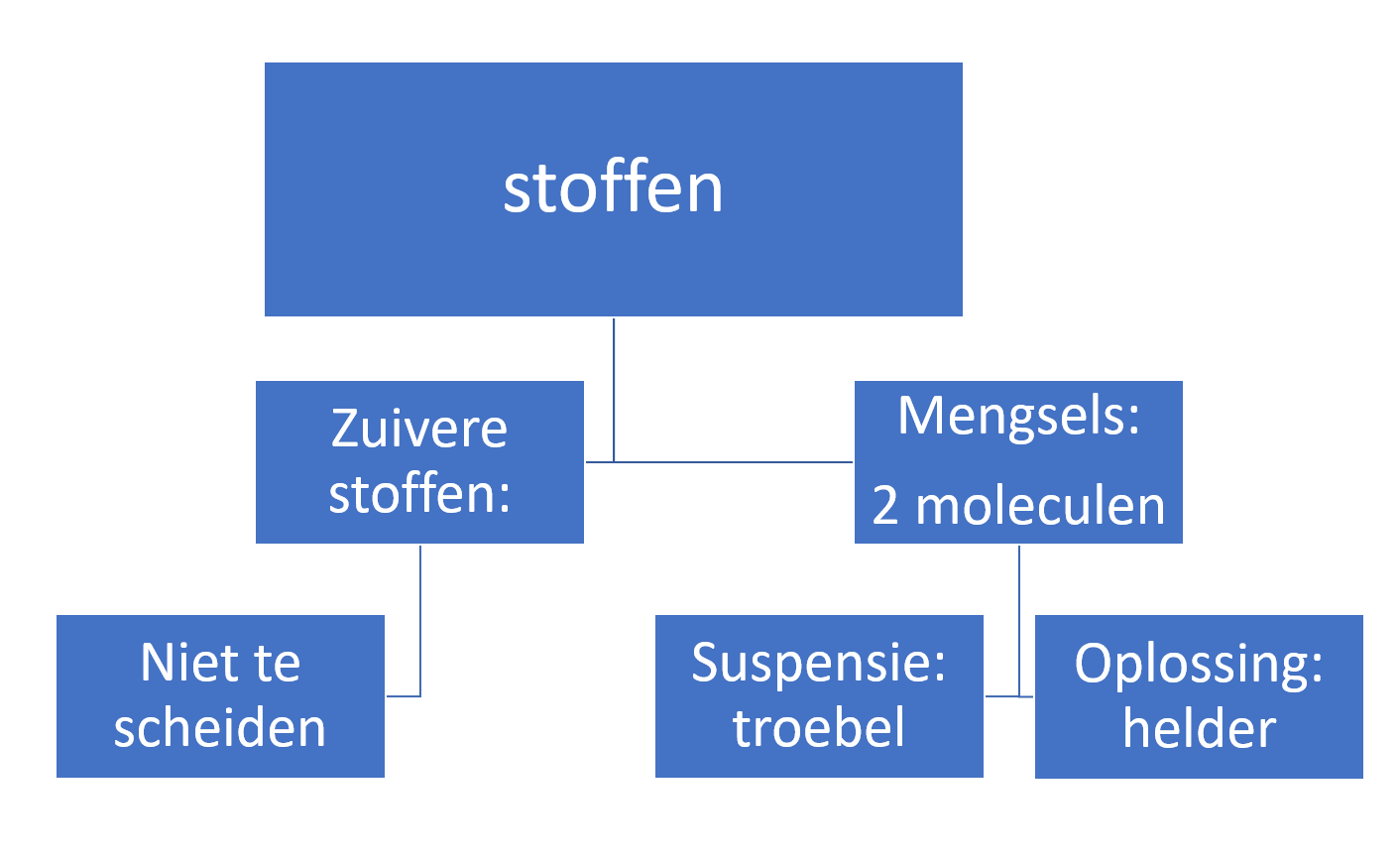
 Bij filtreren maak je gerbuik van een trechter en een filtreerpapiertje. Dit filterpapier moet je op de juiste manier vouwen, anders werkt het niet goed. In de afbeelding hiernaast zie je hoe je een filterpapiertje moet vouwen.
Bij filtreren maak je gerbuik van een trechter en een filtreerpapiertje. Dit filterpapier moet je op de juiste manier vouwen, anders werkt het niet goed. In de afbeelding hiernaast zie je hoe je een filterpapiertje moet vouwen.





 Het middelste grote rondje is een stukje actieve koolstof. De moleculen die daarnaast zijn getekend zijn bijvoorbeeld kleurstof moleculen of andere ongewenste stoffen. De kleustof moleculen plakken vast aan de actieve koolstof. Je verwijdert daarmee geur-, kleur en smaktstoffen uit een mengsel.
Het middelste grote rondje is een stukje actieve koolstof. De moleculen die daarnaast zijn getekend zijn bijvoorbeeld kleurstof moleculen of andere ongewenste stoffen. De kleustof moleculen plakken vast aan de actieve koolstof. Je verwijdert daarmee geur-, kleur en smaktstoffen uit een mengsel. De lucht die de brandweer indemt zit vol met giftige stoffen. Daarom heeft de brandweer een gasmasker op. De giftige stoffen worden door het gasmasker geadsorbeert en hierdoor kunnen de brandweermannen toch veilig ademhalen.
De lucht die de brandweer indemt zit vol met giftige stoffen. Daarom heeft de brandweer een gasmasker op. De giftige stoffen worden door het gasmasker geadsorbeert en hierdoor kunnen de brandweermannen toch veilig ademhalen.
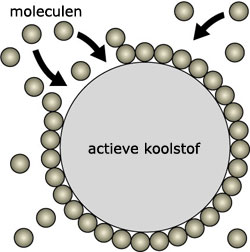
 In het thee zakje zitten theekruiden, deze kruiden zijn gedroogd en in een zakje gedaan. Je voegt hier warm water bij toe. In warm water lost meer vaste stof op dan in koud water. Het warme water heet het extractiemiddel. Uit de theekruiden lossen drie dingen op: kleurstoffen, geurstoffen en de smaakstoffen. De theekruiden zelf lossen niet op en blijven in het theezakje zitten.
In het thee zakje zitten theekruiden, deze kruiden zijn gedroogd en in een zakje gedaan. Je voegt hier warm water bij toe. In warm water lost meer vaste stof op dan in koud water. Het warme water heet het extractiemiddel. Uit de theekruiden lossen drie dingen op: kleurstoffen, geurstoffen en de smaakstoffen. De theekruiden zelf lossen niet op en blijven in het theezakje zitten.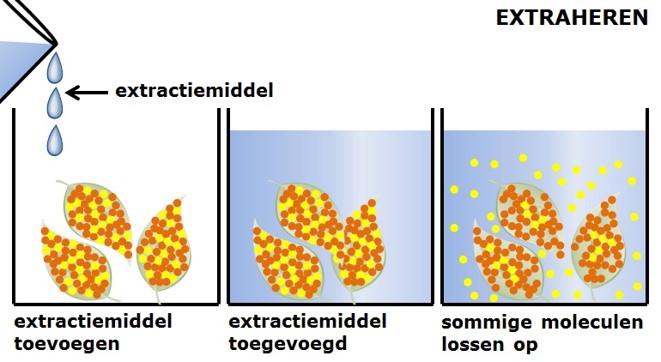 In de schematische tekening hiernaast zie je hoe extraheren in zijn werk gaat.
In de schematische tekening hiernaast zie je hoe extraheren in zijn werk gaat. De dichtheid is de massa van een blokje van 1 cm3
De dichtheid is de massa van een blokje van 1 cm3

 Deze methode kan worden gebruikt om het volume van een stof te meten.
Deze methode kan worden gebruikt om het volume van een stof te meten.


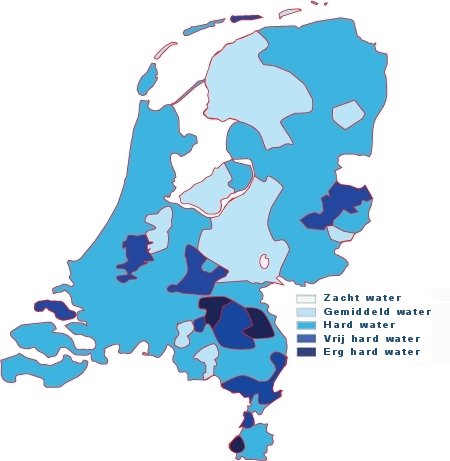
 Als je op de douchekop kijkt, de waterkoker, vaatwasser, eigenlijk overal waar je water in huis gebruikt kom je kalkaanslag tegen.
Als je op de douchekop kijkt, de waterkoker, vaatwasser, eigenlijk overal waar je water in huis gebruikt kom je kalkaanslag tegen.
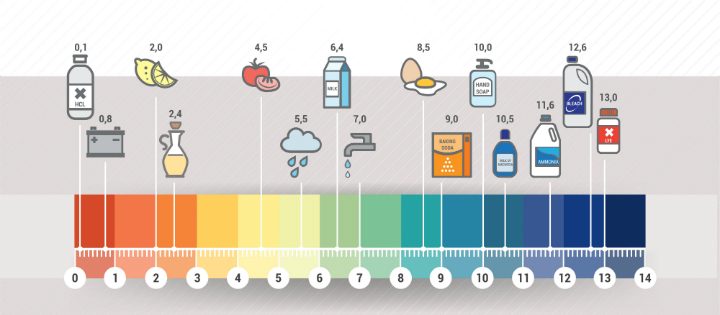
 De pH van een stof kan je meten met behulp van indicator. Een indicator is een stof die een andere stof aantoont, in dit geval is het pH papier. Hier kan je als volgt mee werken:
De pH van een stof kan je meten met behulp van indicator. Een indicator is een stof die een andere stof aantoont, in dit geval is het pH papier. Hier kan je als volgt mee werken: Scheur een klein stukje pH-papier af en leg het op je tafel op een gewoon stuk papier.
Scheur een klein stukje pH-papier af en leg het op je tafel op een gewoon stuk papier.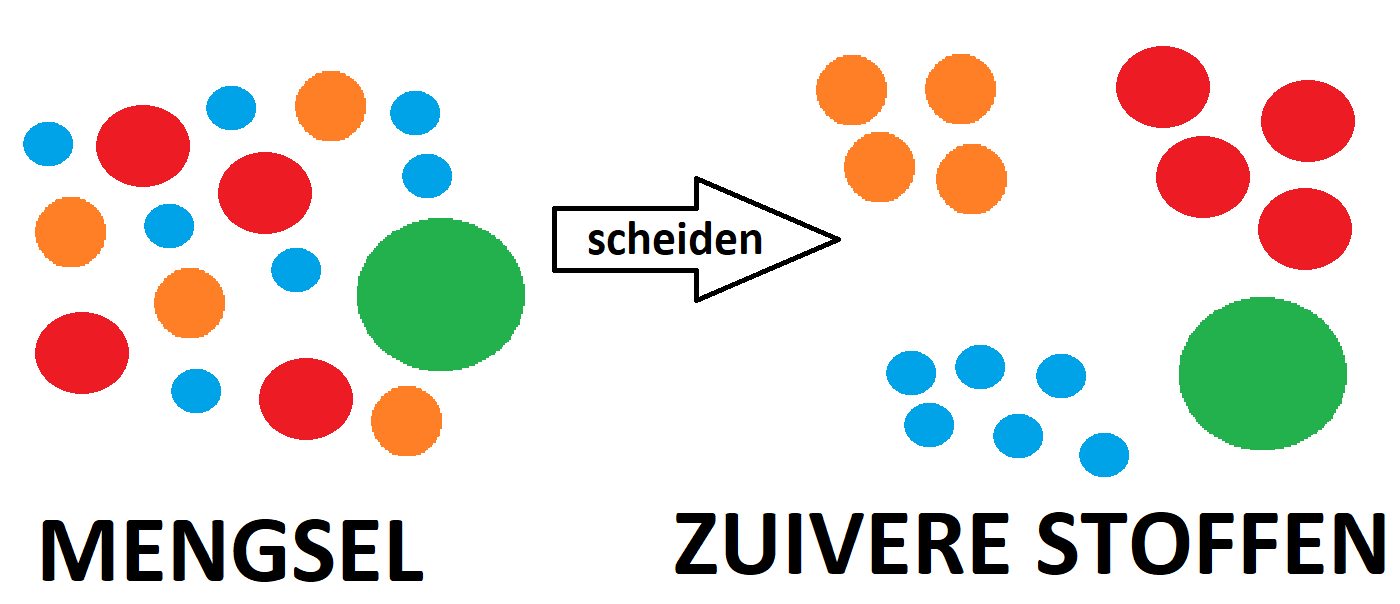


 Eindopdracht hoofdstuk 5
Eindopdracht hoofdstuk 5
