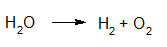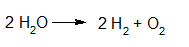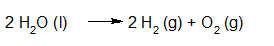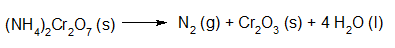Het arrangement Chemische Reacties is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 13-11-2017 23:01:07
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 3.0 Nederland licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Leerniveau
- VMBO gemengde leerweg, 2; VMBO kaderberoepsgerichte leerweg, 1; VWO 2; VMBO kaderberoepsgerichte leerweg, 2; VMBO basisberoepsgerichte leerweg, 4; VMBO gemengde leerweg, 3; VMBO basisberoepsgerichte leerweg, 1; VMBO theoretische leerweg, 1; HAVO 4; HAVO 1; VMBO theoretische leerweg, 4; VWO 6; VMBO gemengde leerweg, 1; VMBO theoretische leerweg, 2; VMBO basisberoepsgerichte leerweg, 2; HAVO; VWO 1; VWO; HAVO 3; VWO 3; VMBO; HAVO 5; VWO 4; VMBO theoretische leerweg, 3; VMBO basisberoepsgerichte leerweg, 3; VMBO kaderberoepsgerichte leerweg, 4; HAVO 2; VMBO gemengde leerweg, 4; VWO 5; VMBO kaderberoepsgerichte leerweg, 3;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 0 uur 50 minuten
- Trefwoorden
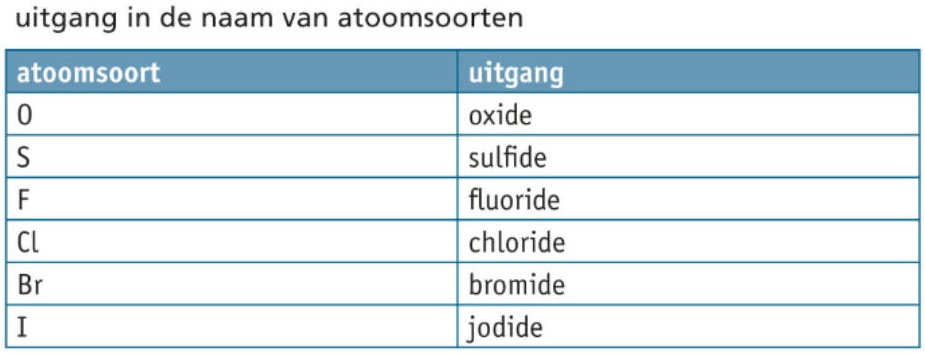
- amorf, amorfe koolstof, anorganische vebinding, anorganische vebindingen, atoomsoort, atoomsoorten, beginstof, beginstoffen, blussen, brand, brandstof, brandstoffen, buskruit, chemie, chemische reactie, chemische reacties, coefficient, coefficienten, diamant, dynamiet, edelgas, edelgassen, effecten tijdens het verloop van reacties, elektrolyse, element, elementen, endotherm, endotherme reactie, endotherme reacties, energetische effecten, energie-effect, exotherm, exotherme reactie, exotherme reacties, explosie, fotografie, fotolyse, fullereen, grafiet, halogeen, halogenen, koolstofverbinding, koolstofverbindingen, lavoisier, lichtgevoelig, macroscopisch, massabehoud, massaverhouding, metaal, metalen, microscopisch, molecuulformule, molecuulformules, niet-ontleedbare stof, niet-ontleedbare stoffen, ontbrandingstemperatuur, ontleding, ontledingsproduct, ontledingsproducten, ontledingsreactie, ontleedbaarheid, ontleedbare stof, ontleedbare stoffen, onvolledige verbranding, organische verbinding, organische verbindingen, oxidatie, oxidatiereactie, oxidatiereacties, oxidaties, oxide, processen/reacties, proust, pyrolyse, reactant, reactanten, reactie, reactiepijl, reactieproduct, reactieproducten, reacties, reactieschema, reactietype, reactietypen, reactievergelijking, reactievergelijkingen, rendement, scheikunde, springstof, springstoffen, thermolyse, toestandsaanduiding, uitgangsstof, uitgangsstoffen, verbinding, verbindingen, verbranding, verbrandingsreactie, verbrandingsreacties, verbrandingswarmte, vergelijking, vergelijkingen, volledige verbranding, vorming, vormingsreactie, vormingsreacties, vuurverschijnsel, vuurverschijnselen, vuurwerk, warmte-effect
Bronnen
| Bron | Type |
|---|---|
|
Proefje: Ontleding van kwik(II)oxide in kwik en zuurstof. https://youtu.be/0y9NOyTgJ88?rel=0 |
Video |
|
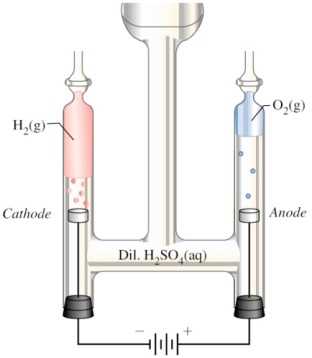
Elektrolyse van water met het toestel van Hoffman. https://youtu.be/dHfevURG2gM?rel=0 |
Video |
|
Proefje: De fotolyse van zilverchloride. https://youtu.be/KY7sI0q4ZYk?rel=0 |
Video |
|
Proefje: de ontleding van ammoniumdichromaat. https://youtu.be/nyjIPOkZ_1U?rel=0 |
Video |
Gebruikte Wikiwijs Arrangementen
Lutgerink, Jan. (2013).
Sk-05 Chemische Reacties