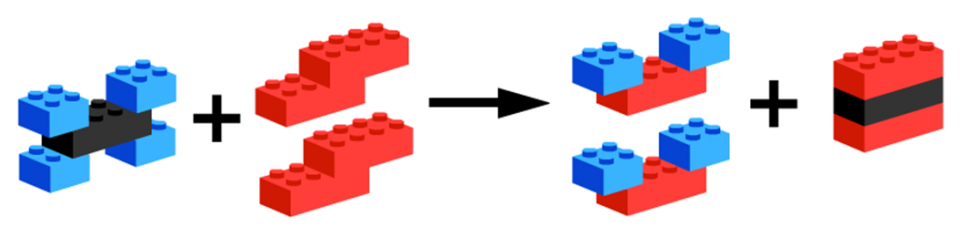
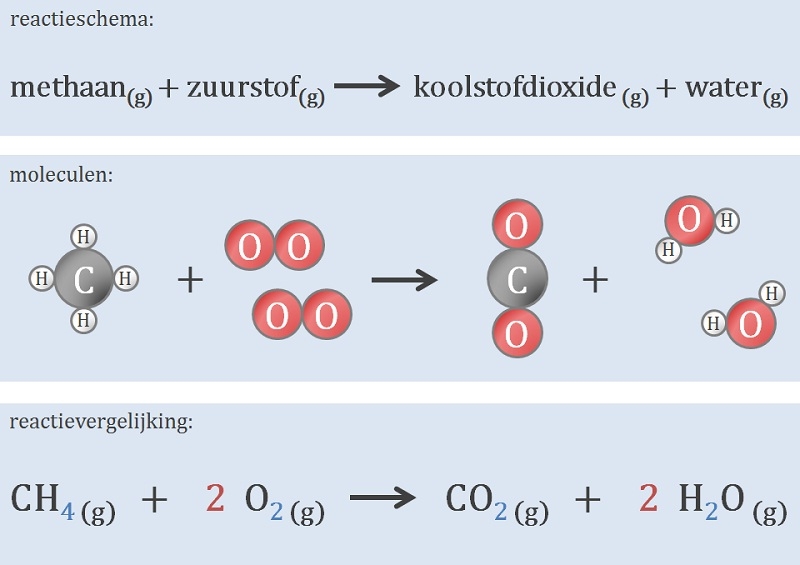
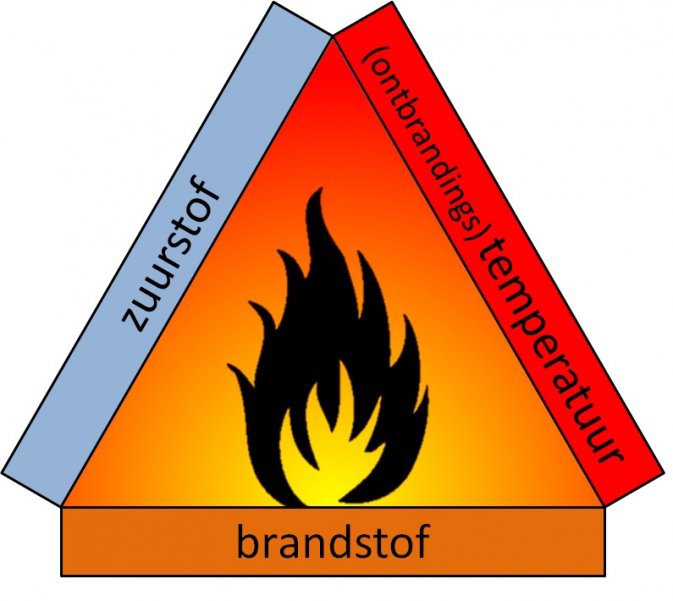
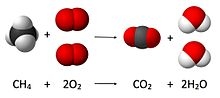
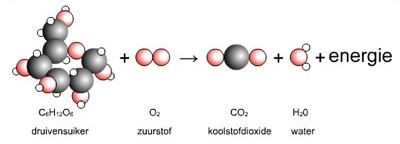
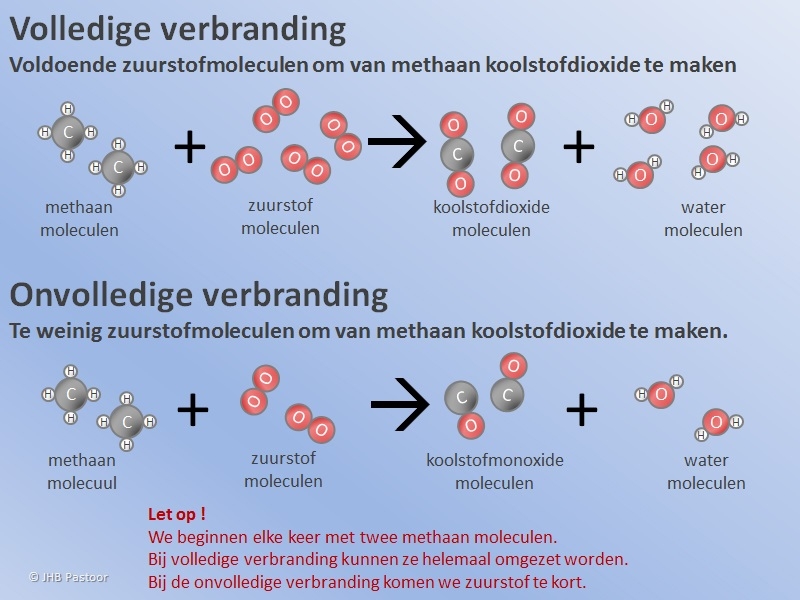
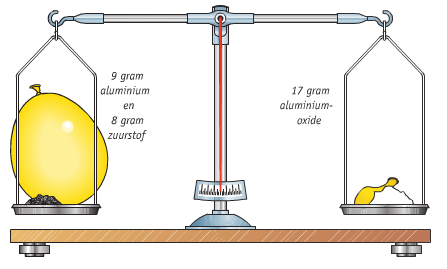
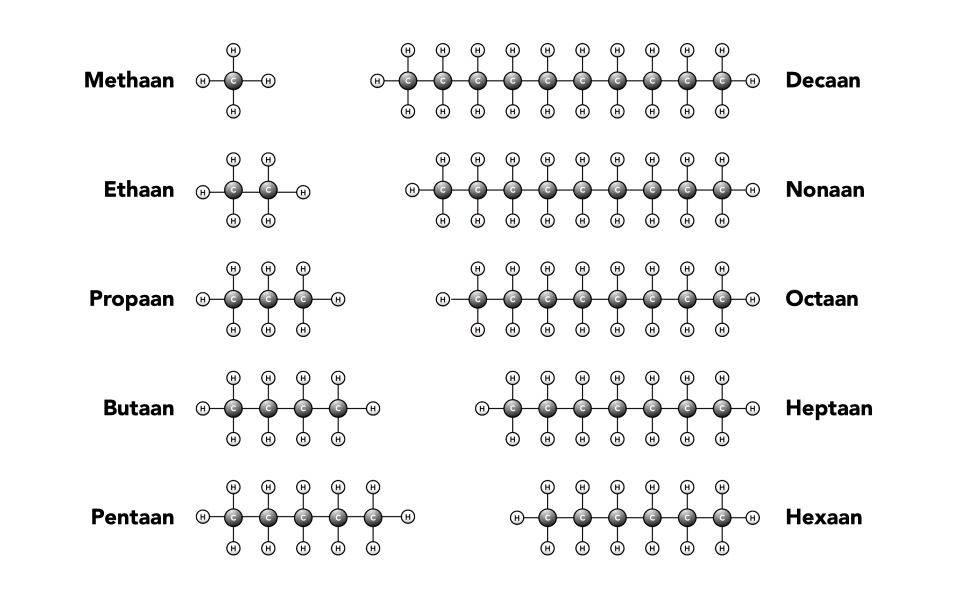Het arrangement Thema 6: Chemische reacties is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteurs
- Laatst gewijzigd
- 20-02-2023 14:34:47
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 3.0 Nederlands licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
Bronnen
| Bron | Type |
|---|---|
|
Chemische reacties https://www.youtube.com/watch?v=KTacZhvkyIA&app=desktop |
Video |
|
Direct naar de 'dichtheid berekeningen' van thema 3 http://maken.wikiwijs.nl/70177/Thema_3__Duurzaamheid#!page-1738952 |
Link |
|
Volledige opdracht branddriehoek https://1drv.ms/w/s!Ah2EAzT7Gg4biPRBtZ-z9eY_bpdIHQ |
Link |
|
Rekenen met massaverhouding https://1drv.ms/w/s!Ah2EAzT7Gg4bhPYZs2qLf8K0SuPB0g |
Link |
|
De antwoorden https://1drv.ms/w/s!Ah2EAzT7Gg4bhclMlW67FsEbClRUnQ?e=wmwQYP |
Link |
|
Diagnostische toets thema 6 https://1drv.ms/w/s!Ah2EAzT7Gg4bhclAqw6DeW7mvN8Reg |
Link |
|
Correctiemodel diagnostische toets https://1drv.ms/w/s!Ah2EAzT7Gg4bhclGHO0zsGZHI8LVRg |
Link |