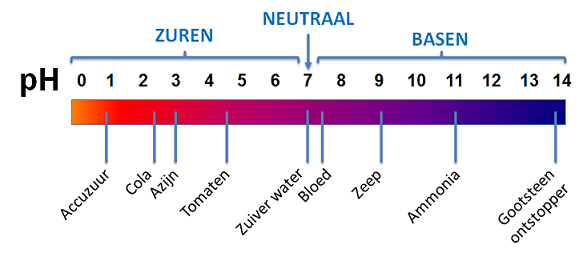
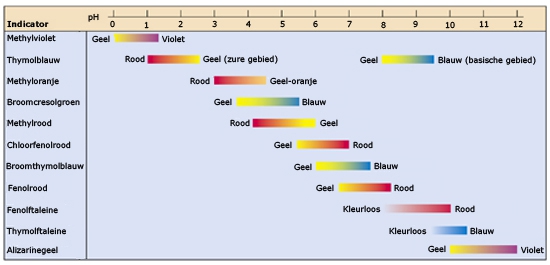
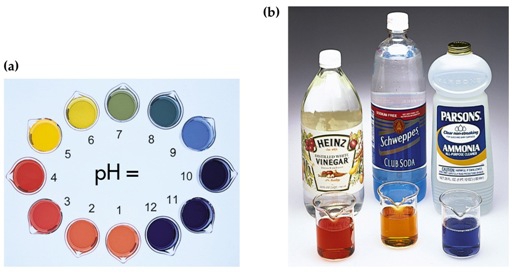
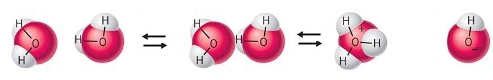
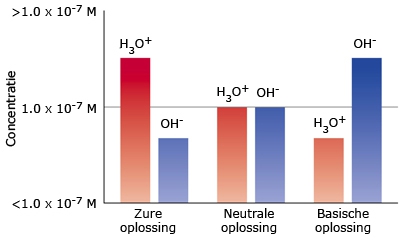
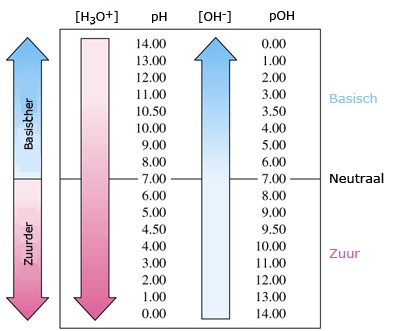
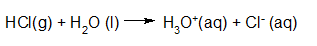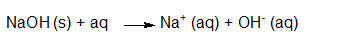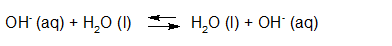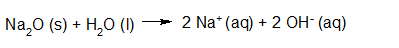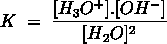Het arrangement Sterke zuren en basen is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 22-10-2016 07:53:30
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 3.0 Nederland licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Leerniveau
- VWO 6; VWO 5;
- Leerinhoud en doelen
- Schaal, verhouding en hoeveelheid; Chemische reacties; Scheikunde; Analyse technieken; Reactiviteit; Chemische processen;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Trefwoorden
- basen, indicator, ph, poh, protonacceptor, protondonor, reacties, titratie, zuren, zuurgraad
Bronnen
| Bron | Type |
|---|---|
|
Rode koolsap als zuur-base-indicator https://youtu.be/4NPFyyLwNG4 |
Video |
|
Korte video-samenvatting over basen https://youtu.be/JiF-xK8W3cg |
Video |
|
Voorbeeld 1: reactie tussen zoutzuur en natronloog https://youtu.be/Eb4odpRh0SI |
Video |
|
Voorbeeld 2: reactie tussen zoutzuur en vast calciumcarbonaat https://youtu.be/l1YKUKjhOXk |
Video |
|
Voorbeeld 3: reactie tussen barietwater en verdund zwavelzuur https://youtu.be/asCtXeArVkY |
Video |
|
Youtube video: uitleg over het rekenen met de pH en pOH https://youtu.be/A_N7Es4XhSQ |
Link |
|
Uitleg over het gebruik van de pipet https://youtu.be/5qS8X306H6o |
Video |
|
Uitleg over het gebruik van de buret en pipet https://youtu.be/JAXSaDJuGNU |
Video |
Gebruikte Wikiwijs Arrangementen
scheikunde sectie. (z.d.).
Zuren en basen - herhaling
Vredenburg, Galvin. (z.d.).
Sterke zuren en basen bronmateriaal
https://maken.wikiwijs.nl/86750/Sterke_zuren_en_basen_bronmateriaal