Het arrangement Evenwichten is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 02-10-2016 23:52:06
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 3.0 Nederland licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Uitleg over chemische evenwichten voor vwo leerlingen. Voornamelijk korte instructie-video's over het rekenen aan chemische evenwichten, rekenen met de evenwichtsvoorwaarde en het beredeneren aan evenwichtsverstoringen.
- Leerniveau
- VWO 4; VWO 5;
- Leerinhoud en doelen
- Chemisch evenwicht; Scheikunde; Reactiviteit;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Trefwoorden
- boem-schema, boem-tabellen, evenwicht, evenwichtsconstante, evenwichtsverschuiving, evenwichtsverstoring, evenwichtsvoorwaarde, le chatelier
Bronnen
| Bron | Type |
|---|---|
|
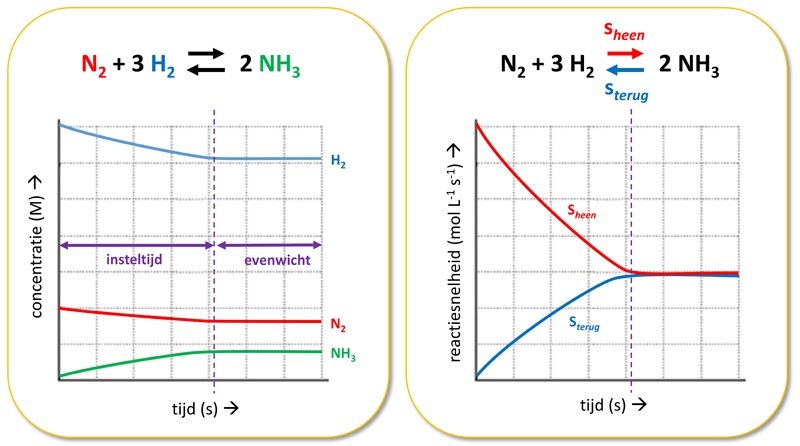
Uitleg over reactiesnelheid-tijd en concentratie-tijd grafieken bij evenwichtsreacties https://youtu.be/KQ25y_Y0Krk |
Video |
|
Rekenen aan evenwichtsreacties: het BOEM-schema https://youtu.be/pdnwD-vTg_E |
Video |
|
Uitleg over het opstellen van de concentratiebreuk bij een evenwichtsreactie https://youtu.be/NiFl0uAGArA |
Video |
|
Korte uitleg over het opstellen van de evenwichtsvoorwaarde https://youtu.be/_B3c5T7-CUE |
Video |
|
Is er sprake van een evenwicht? Berekening mbv evenwichtsvoorwaarde https://youtu.be/Cj4nkDX6nF0 |
Video |
|
Berekening van de evenwichtsconstante K mbv de evenwichtsvoorwaarde en BOEM-tabel https://youtu.be/zbZ9yRBOLX0 |
Video |
|
Korte introductie over het principe van Le Chatelier https://youtu.be/uhy27hQHXCE |
Video |
|
Uitleg evenwichtsverstoring: verandering van concentratie (hier: stof toevoegen). Overigens kun je deze uitleg ook "andersom" gebruiken om uit te leggen dat een reactie aflopend wordt als je continu een stof weghaalt. https://youtu.be/-28FNXPY8Eo |
Video |
|
Uitleg evenwichtsverstoring: verandering van druk / volume (hier: druk verdubbelen). Overigens kun je deze uitleg ook "andersom" gebruiken om uit te leggen wat er gebeurt bij bijvoorbeeld verdunnen van een oplossing. https://youtu.be/rEPbHQPlIwk |
Video |
|
Uitleg evenwichtsverstoring: verandering van temperatuur. https://youtu.be/Snm9XqUSucI |
Video |