Het arrangement Thema: Energie in je broekzak vwo456 is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 21-01-2025 20:04:10
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Colofon
De module Energie om mee te nemen is ontwikkeld door Sander Bons en medewerkers van StudioVO op basis van materiaal van xxxxxxxxxxxxxxxxxx.
Bij het ontwikkelen van het materiaal is gebruik gemaakt van of wordt verwezen naar materiaal van de volgende websites:
Fair Use
In de Stercollecties van StudioVO wordt gebruik gemaakt van beeld- en filmmateriaal dat beschikbaar is op het internet. Bij het gebruik zijn we uitgegaan van fair use.
Meer informatie: Fair use .
Mocht u vragen/opmerkingen hebben,
neem dan contact op via de helpdesk VO-Content .
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
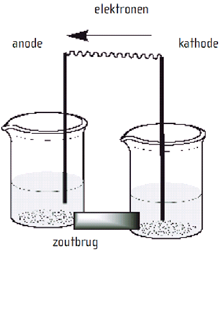
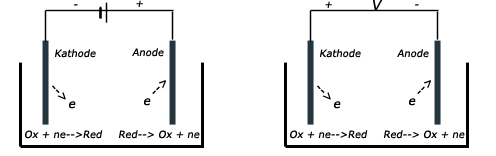
- Dit thema valt onder de arrangeerbare leerlijn van de Stercollecties voor scheikunde voor vwo leerjaar 456. De volgende onderdelen worden behandeld: energieomzettingen en chemische processen. Belangrijke begrippen hierbij zijn: donor/reductor acceptor/oxidator halfreactie halfreacties; positieve en negatieve elektrode; elektrolyt; opladen; recycling; verhouding energie/massa.
- Leerniveau
- VWO 6; VWO 4; VWO 5;
- Leerinhoud en doelen
- Energieomzetting; Energie; Scheikunde;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 10 uur 0 minuten
- Trefwoorden
- arrangeerbaar, chemische processen, elektrolyten, energieomzetting, halfreacties, oxidator, reductor, scheikunde, stercollectie, vwo 456

 Batterijen zijn een draagbare vorm van energie. Handig, omdat de stroombron relatief klein is en je ze overal kunt gebruiken. Ze zijn aan de andere kant erg duur. Bovendien kleven er allerlei milieubezwaren aan batterijen.
Batterijen zijn een draagbare vorm van energie. Handig, omdat de stroombron relatief klein is en je ze overal kunt gebruiken. Ze zijn aan de andere kant erg duur. Bovendien kleven er allerlei milieubezwaren aan batterijen. Wat ga ik doen?
Wat ga ik doen? Wij gaan:
Wij gaan: