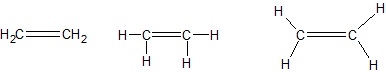
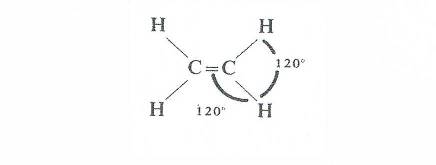
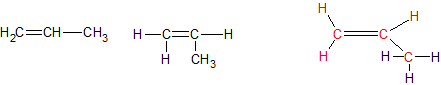
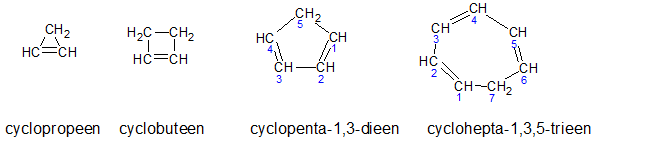
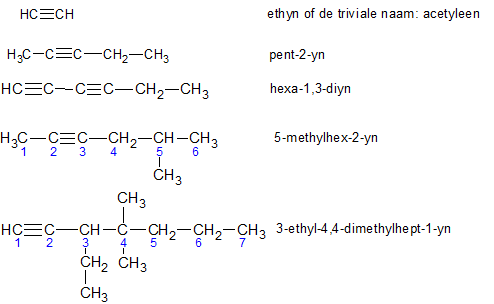
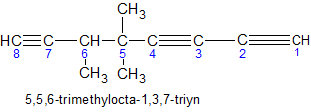
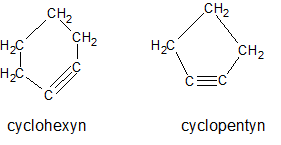
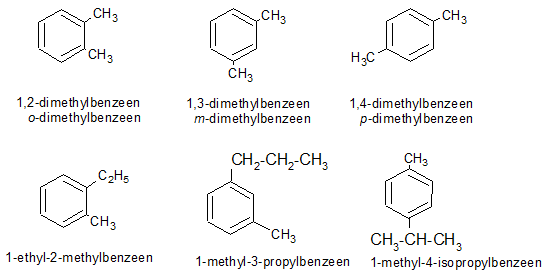
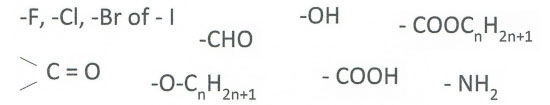
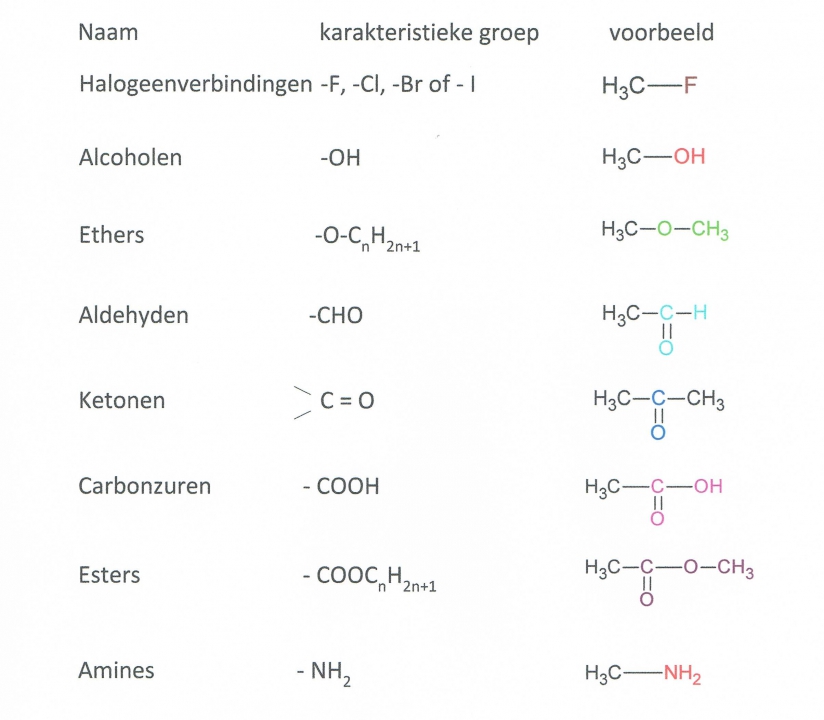
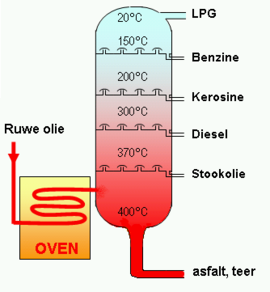
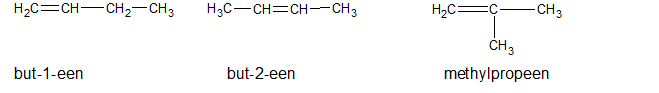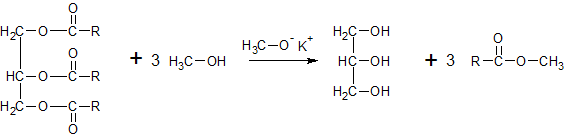Het arrangement Sk-06 Koolwaterstoffen is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 22-03-2016 21:45:45
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 3.0 Nederland licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
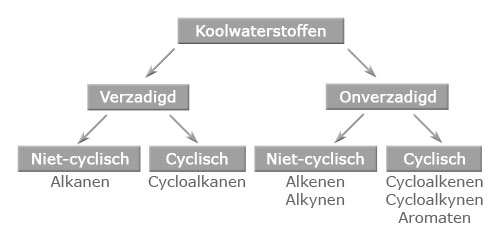
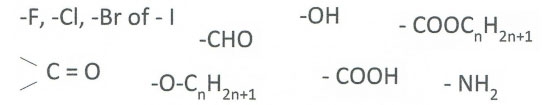
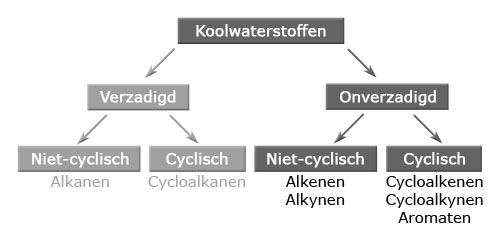
- Vakinhoudelijk deel van een thema over koolwaterstoffen, omgezet in een Wikiwijs arrangement vanuit een prototype van een kennisbank scheikunde van het voormalige Ruud de Moor Centrum van de OU; zie ook de colofon in het arrangement voor toelichting. Samenvatting: Koolwaterstoffen zijn verbindingen die uitsluitend bestaan uit koolstofatomen en waterstofatomen. We maken onderscheid tussen verzadigde en onverzadigde koolwaterstoffen. We kunnen ook een onderscheid maken tussen cyclische en niet-cyclische koolwaterstoffen. Koolwaterstoffen zijn het hoofdbestanddeel van fossiele brandstoffen, waarvan aardolieproducten bruikbaar zijn als brandstof of als grondstof voor de petrochemische industrie.
- Leerniveau
- VWO 2; HAVO 4; HAVO 1; VWO 6; HAVO; VWO 1; VWO; HAVO 3; VWO 3; HAVO 5; VWO 4; HAVO 2; VWO 5;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leraar
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 0 uur 50 minuten
Bronnen
| Bron | Type |
|---|---|
|
https://youtu.be/mode2isDo4s https://youtu.be/mode2isDo4s |
Video |
|
Naamgeving van de isomeren van butaan, pentaan en hexaan door Sieger Kooij. https://youtu.be/JQCq1a6v8D8?rel=0 |
Video |
|
Aan de orde komen: halogeenalkanen, alkaanzuren (carbonzuren) en alkanolen (alcoholen). https://youtu.be/1YoySXu6WxQ?rel=0 |
Video |
|
Het ontstaan van olie in Texas, tussen 542 - 251 miljoen jaar geleden, toen Texas nog onder water stond. https://youtu.be/z0C6QYp_6_0?rel=0 |
Video |
|
Destillatie van ruwe aardolie. Bron: www.schooltv/beeldbank https://www.schooltv.nl/beeldbank/embedded.jsp?clip=20031208_06_01destaa |
Video |
|
Waarom zijn schotellagen en borrelkappen onmisbaar in een echte destillatietoren? https://www.schooltv.nl/beeldbank/embedded.jsp?clip=20031208_06_02schotb |
Video |
|
Model van een borrelkapje. https://www.schooltv.nl/beeldbank/embedded.jsp?clip=20031208_06_03modbor |
Video |
|
Hoe breek je grotere moleculen in kleinere? https://www.schooltv.nl/beeldbank/embedded.jsp?clip=20031208_20_01kraken |
Video |
Gebruikte Wikiwijs Arrangementen
Lutgerink, Jan. (2012).
Sk-06 Koolwaterstoffen