Het arrangement Thema: Parfum aangepast nav eklassen is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 16-12-2015 13:53:23
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 3.0 Nederland licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- (Scheikunde VWO 4)
- Leerniveau
- VWO 4;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
Gebruikte Wikiwijs Arrangementen
scheikunde vo-content. (2015).
Thema: Parfum aangepast nav eklassen
https://maken.wikiwijs.nl/69934/Thema__Parfum_aangepast_nav_eklassen








 Gevangen geuren
Gevangen geuren  Op plaatsen waar minder vet onder de huid zit (in de oksels, knieholtes, ellebogen, op de polsen, achter het oor), is de huid warmer en daardoor is het parfum daar beter te ruiken.
Op plaatsen waar minder vet onder de huid zit (in de oksels, knieholtes, ellebogen, op de polsen, achter het oor), is de huid warmer en daardoor is het parfum daar beter te ruiken.

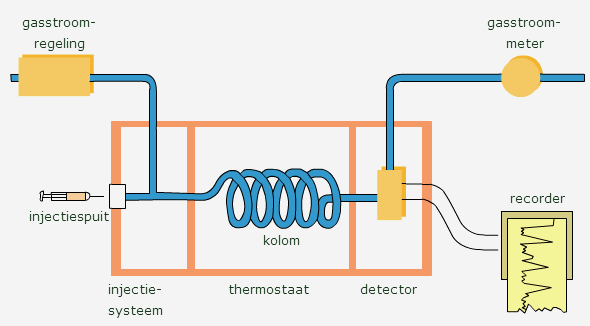
 Voorbereiden
Voorbereiden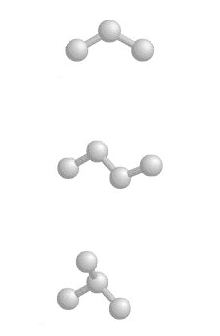

 ALDEHYDEN en KETONEN
ALDEHYDEN en KETONEN
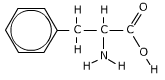
 Bedenk vier opgaven.
Bedenk vier opgaven.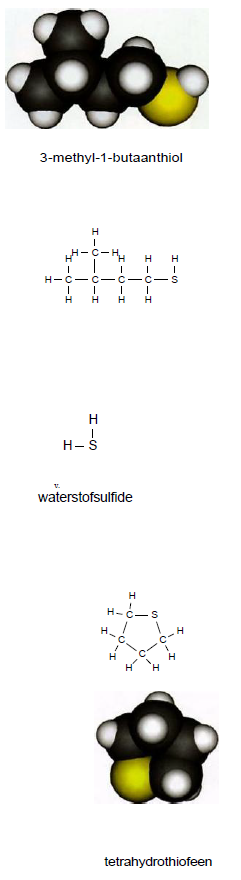 Er zijn veel meer stoffen die stinken. Een scheikundige zegt overigens niet zo gemakkelijk dat een stof stinkt.
Er zijn veel meer stoffen die stinken. Een scheikundige zegt overigens niet zo gemakkelijk dat een stof stinkt.
 Elke groep bestaat uit vier leerlingen. Elke leerling (a, b, c en d) beantwoord zijn eigen vragen.
Elke groep bestaat uit vier leerlingen. Elke leerling (a, b, c en d) beantwoord zijn eigen vragen.



 Haal bij de docent het voorschrift voor de synthese van een geurstof.
Haal bij de docent het voorschrift voor de synthese van een geurstof.
 Besteed een uur aan het checken of je de doelen bereikt hebt. Doe dat door met behulp van je computer of pen en papier antwoorden te geven, zonder te spieken in de module of in je aantekeningen. Werk overzichtelijk, zodat je aan het eind van het uur kunt zien wat je wel weet en kunt en waar je nog aandacht voor moet hebben.
Besteed een uur aan het checken of je de doelen bereikt hebt. Doe dat door met behulp van je computer of pen en papier antwoorden te geven, zonder te spieken in de module of in je aantekeningen. Werk overzichtelijk, zodat je aan het eind van het uur kunt zien wat je wel weet en kunt en waar je nog aandacht voor moet hebben. Besteed thuis een uur aan de voorbereiding van een toets. Probeer om zo min mogelijk te spieken in je aantekeningen. Stel jezelf vragen en geef de antwoorden. Zet het antwoord op papier en kijk daarna of het antwoord juist is. Hou jezelf niet voor de gek. Niet spieken en je er niet te snel vanaf maken. Een uur is een uur.
Besteed thuis een uur aan de voorbereiding van een toets. Probeer om zo min mogelijk te spieken in je aantekeningen. Stel jezelf vragen en geef de antwoorden. Zet het antwoord op papier en kijk daarna of het antwoord juist is. Hou jezelf niet voor de gek. Niet spieken en je er niet te snel vanaf maken. Een uur is een uur.