Het arrangement 25. Tissue Engineering (2012) is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteurs
- Laatst gewijzigd
- 04-05-2015 09:06:30
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 3.0 Nederland licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie.
Dit materiaal is ontwikkeld door: Martijn Adams, Anne-Marie Hollands, Moniek Lamers, Dieuwke Schotanus & Wilbert van de Paal in het kader van het vak betadidactiek binnen de lerarenopleiding van de Eindhoven School of Education (TU/e) in opdracht van het Lorentz Casimir Lyceum.
De gebruikte afbeeldingen en fragmenten zijn door ons gecontroleerd ten aanzien van hun rechtenvrije beschikbaarheid. Mocht hier onverhoopt toch een probleem blijken, neemt u dan contact op met esoe@tue.nl zodat wij het kunnen herstellen.

Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Deze lessenserie is voortgekomen uit een opdracht van het Lorentz Casimir Lyceum (LCL) te Eindhoven en is ontworpen voor een zogenaamd ‘bèta-excellentieuur’. Het lesmateriaal is gericht op leerlingen uit 4 en 5 VWO die bovengemiddeld presteren bij de bètavakken. Het niveau en diepgang van deze lessenserie gaat daarom ook wat verder dan gemiddeld. Het doel is om 'excellente' leerlingen extra te prikkelen en te inspireren. Ook is het lesmateriaal vakoverstijgend met als doel de lesstof buiten het kader van de individuele bètavakken te trekken. Allerlei aspecten uit verschillende individuele bètavakken (natuurkunde, wiskunde, scheikunde, biologie en informatica) komen aan de orde.
- Leerniveau
- VWO 4; VWO 5;
- Leerinhoud en doelen
- Informatica; Biologie; Scheikunde; Rekenen/wiskunde; Natuurkunde;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 4 uur 10 minuten
- Trefwoorden
- beta, cel, engineering, esoe, excellent, tissue


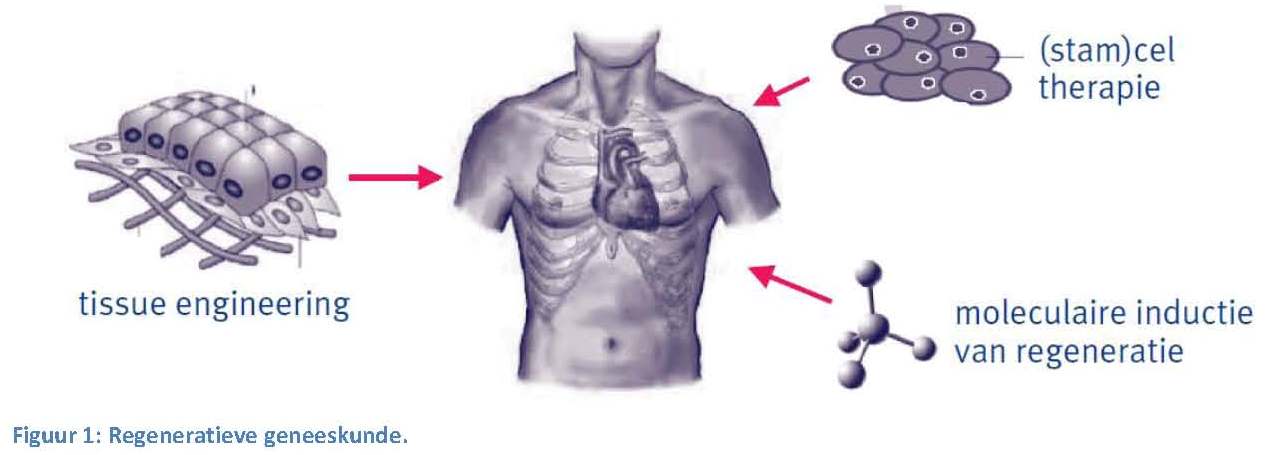


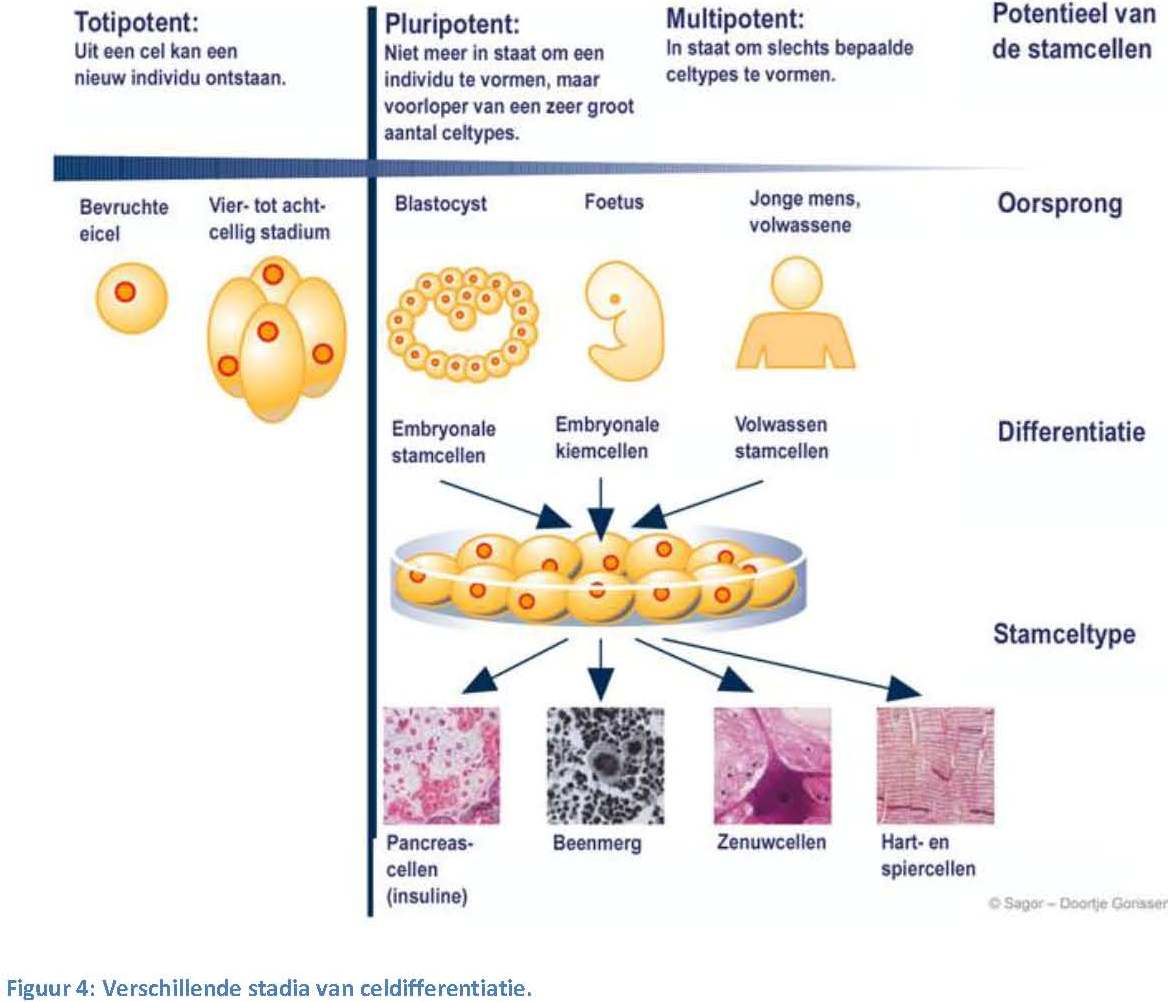 even.
even.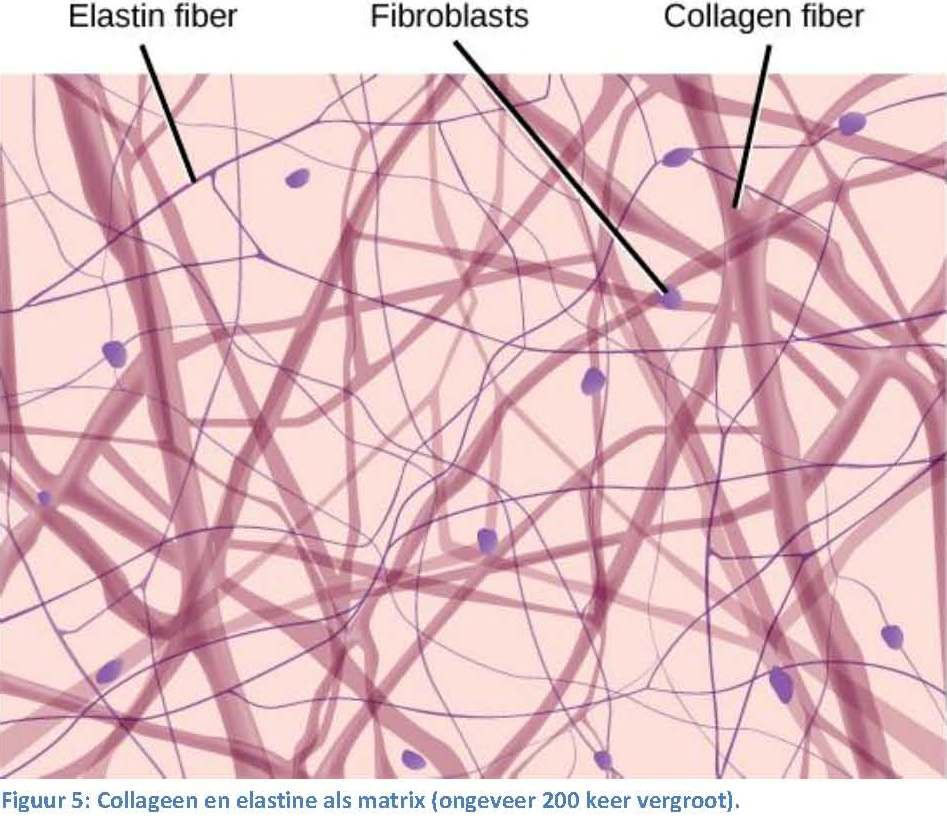
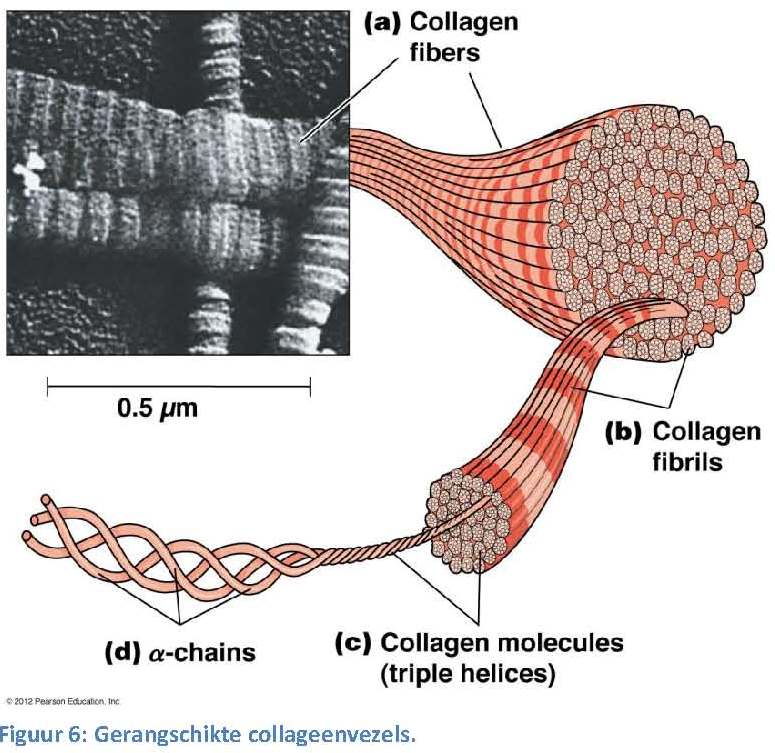
 In Figuur 5 zie je ook fibroblastcellen. Dit zijn cellen die de eiwitten voor de matrix produceren (onder ander collageen dus). De fibroblast produceert ook enzymen die de matrix juist afbreken, en stoffen die de opbouw en afbraak reguleren.
In Figuur 5 zie je ook fibroblastcellen. Dit zijn cellen die de eiwitten voor de matrix produceren (onder ander collageen dus). De fibroblast produceert ook enzymen die de matrix juist afbreken, en stoffen die de opbouw en afbraak reguleren.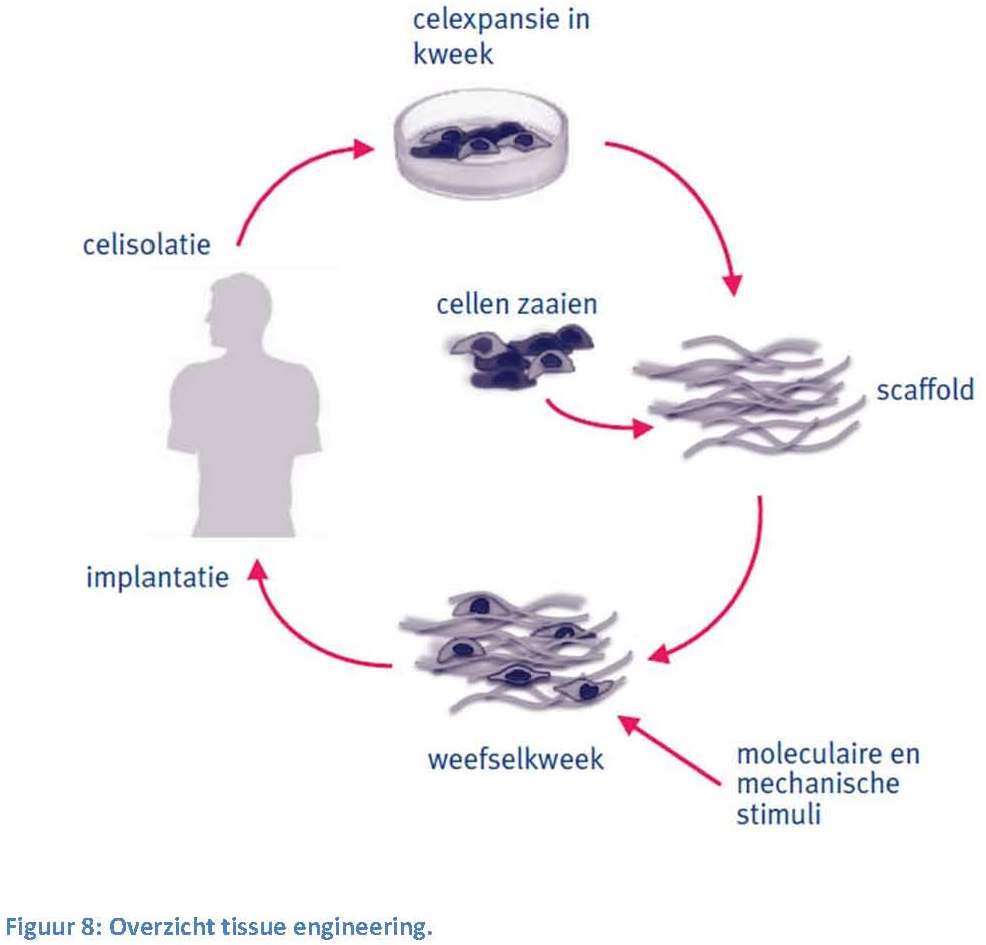

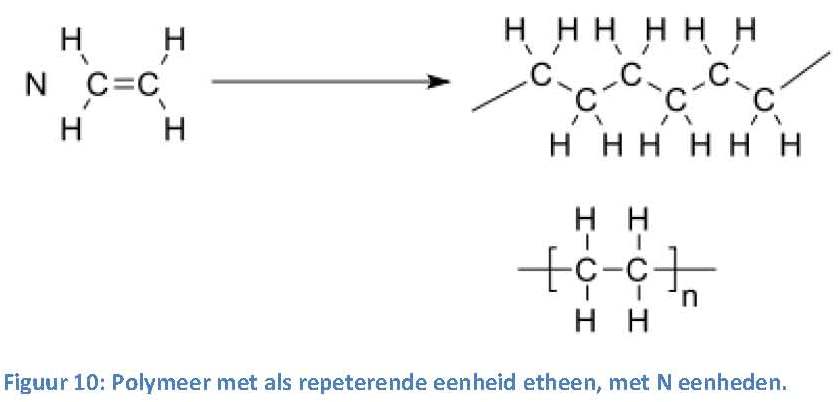
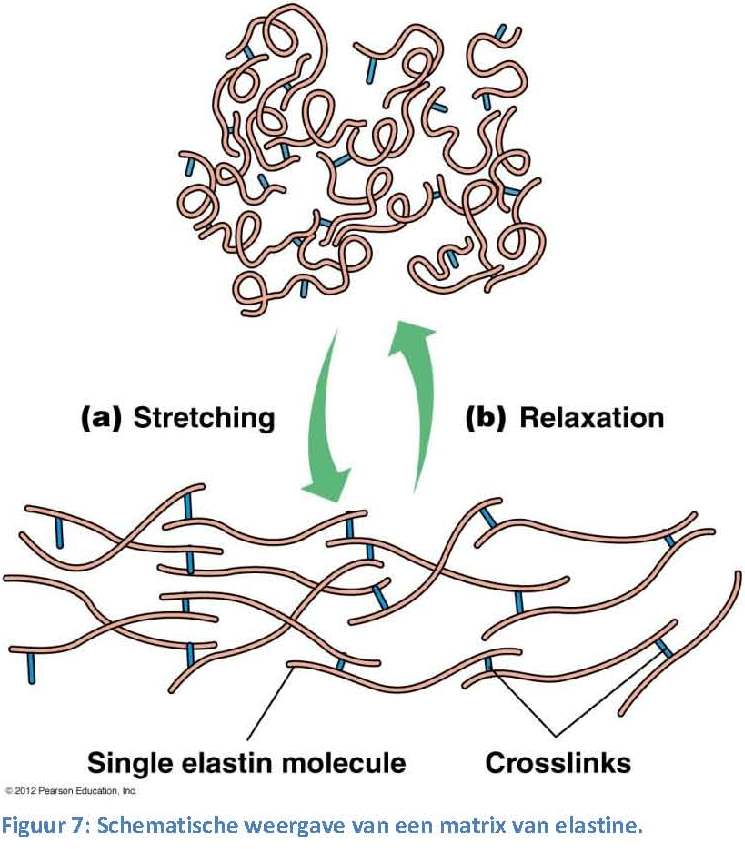
 Een polymeer is een verbinding die uit een lange reeks van bouwstenen van dezelfde soort moleculen bestaat. Deze bouwstenen worden repeterende eenheden of monomeren genoemd. Door zowel het type als het aantal monomeren te veranderen, kun je polymeren met zeer verschillende eigenschappen maken.
Een polymeer is een verbinding die uit een lange reeks van bouwstenen van dezelfde soort moleculen bestaat. Deze bouwstenen worden repeterende eenheden of monomeren genoemd. Door zowel het type als het aantal monomeren te veranderen, kun je polymeren met zeer verschillende eigenschappen maken.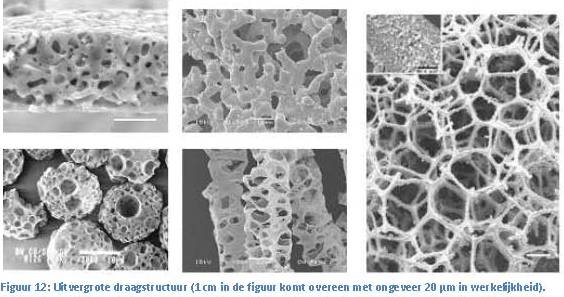
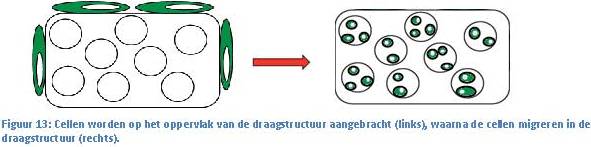
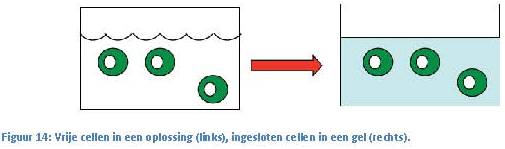
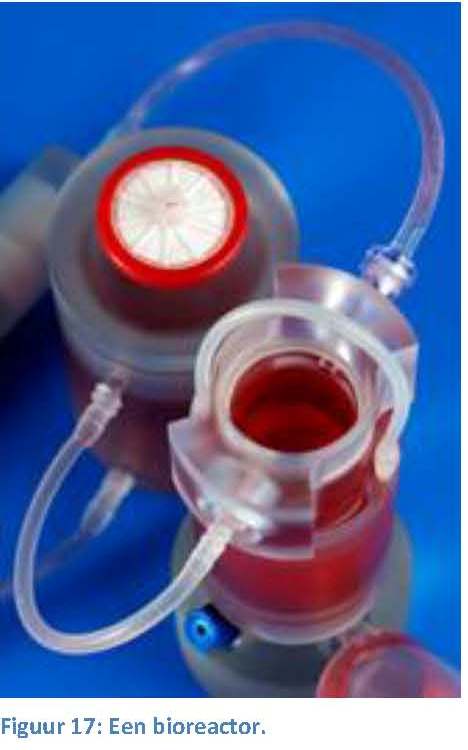
 men we een bioreactor.
men we een bioreactor.