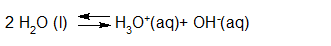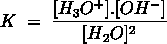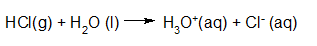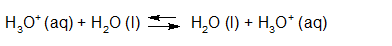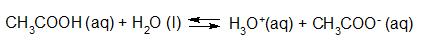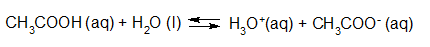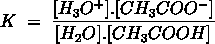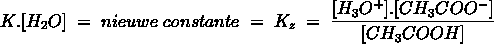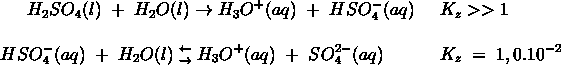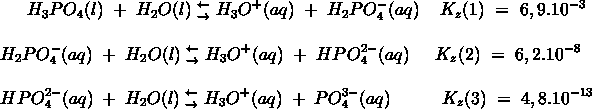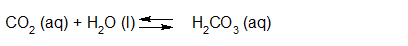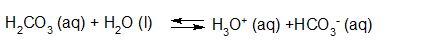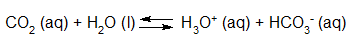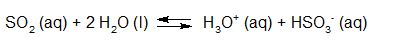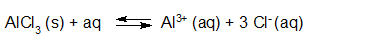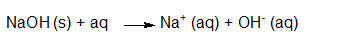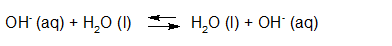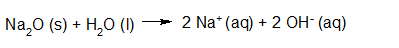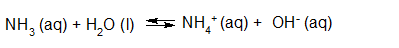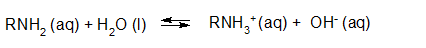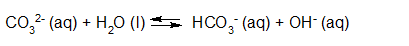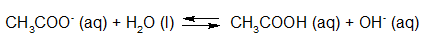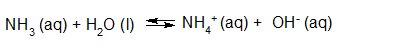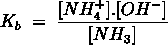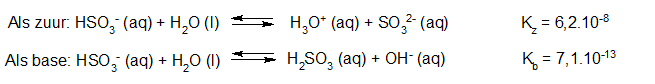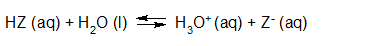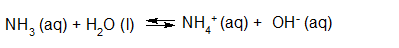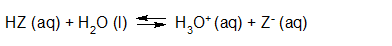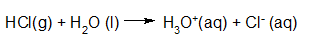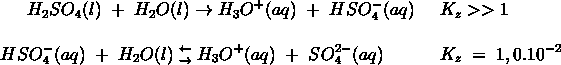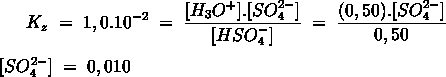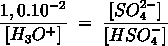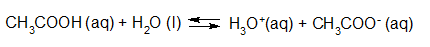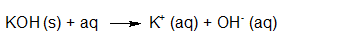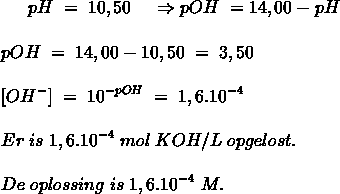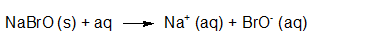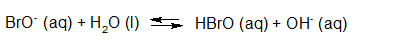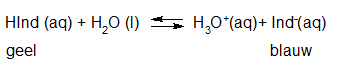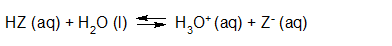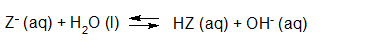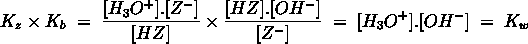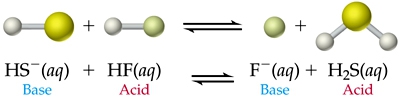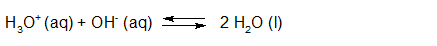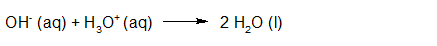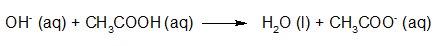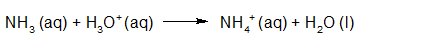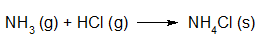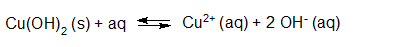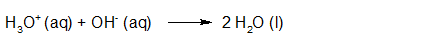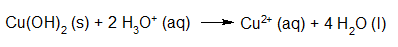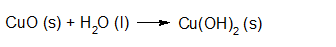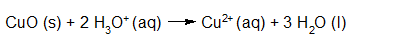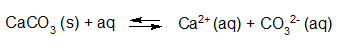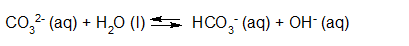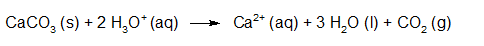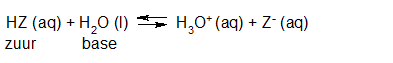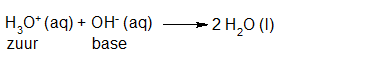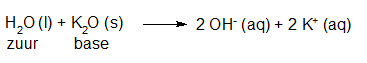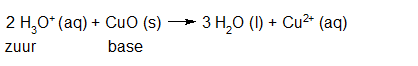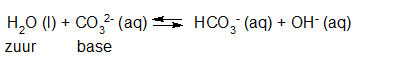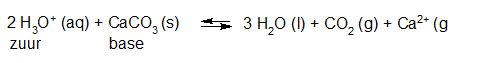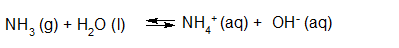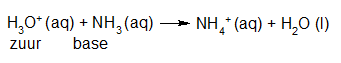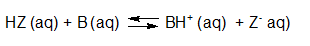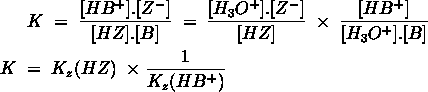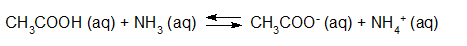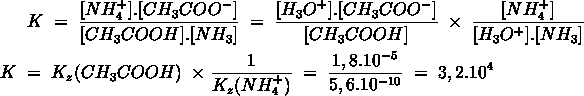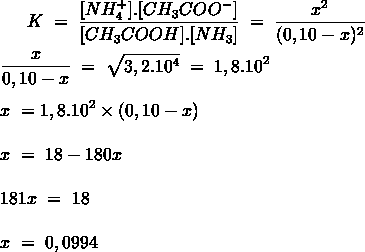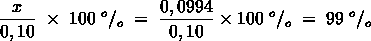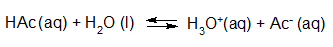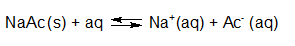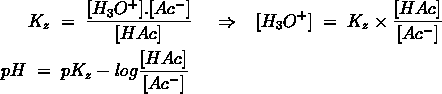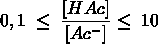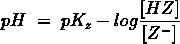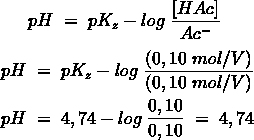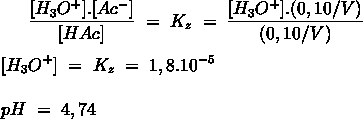Het arrangement Sk-12 Zuren en basen is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteurs
- Laatst gewijzigd
- 03-02-2016 10:26:28
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 3.0 Nederlands licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
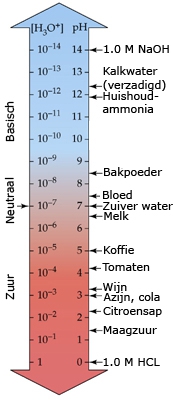
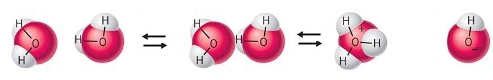
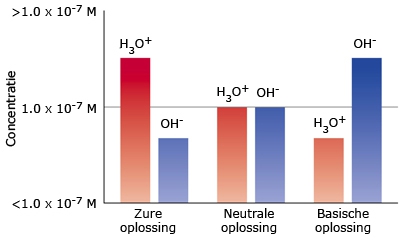
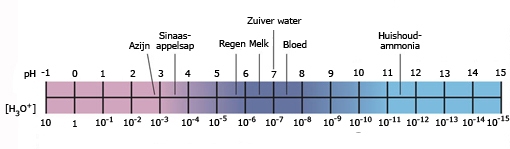
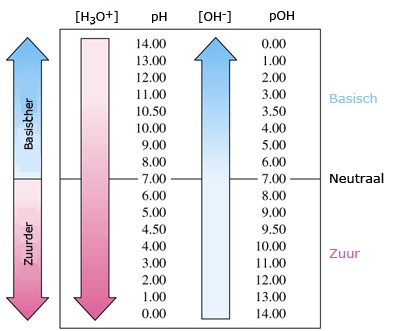
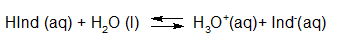
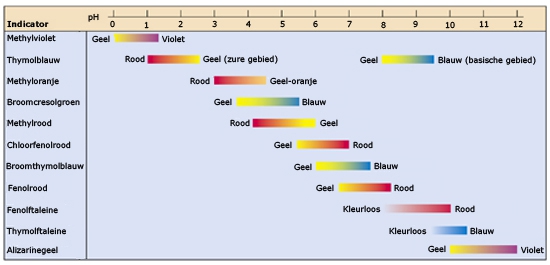
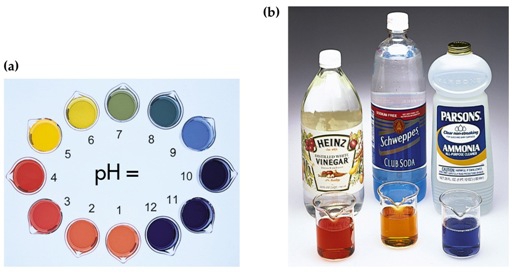
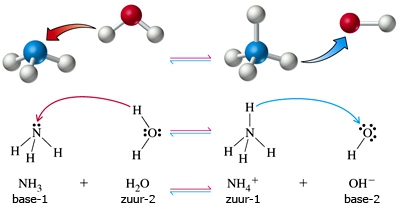
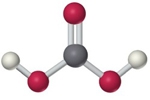
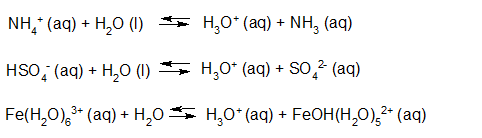
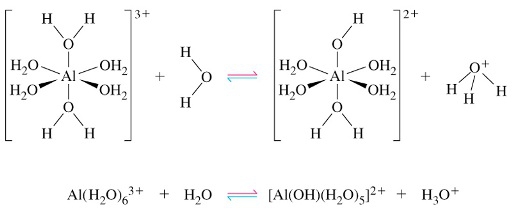
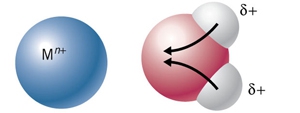
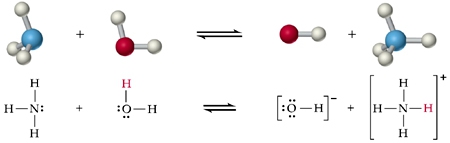
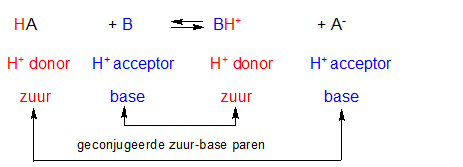
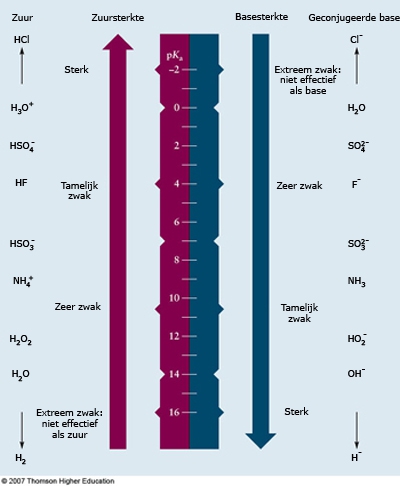
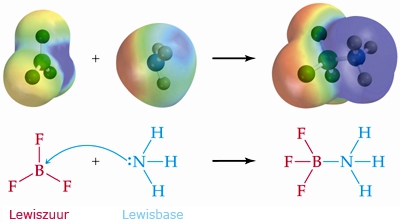
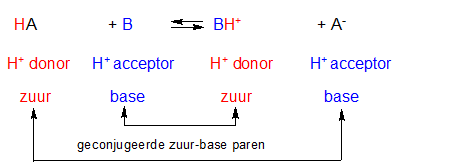
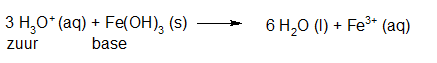
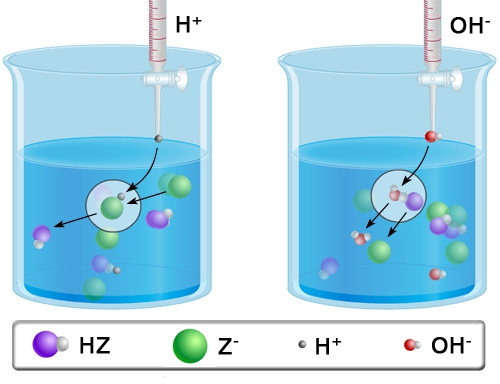
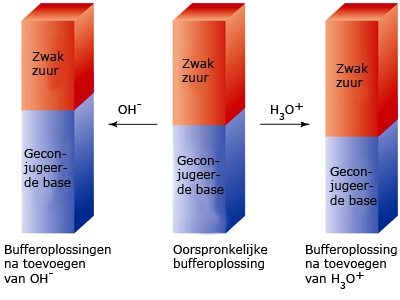
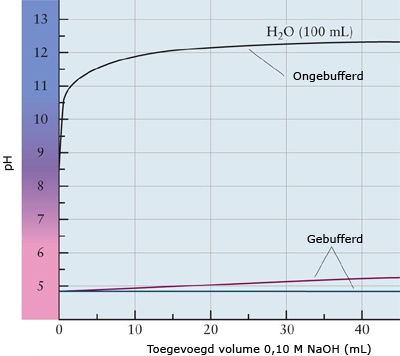
- Vakinhoudelijk deel van een thema over zuren en basen, omgezet in een Wikiwijs arrangement vanuit een prototype van een kennisbank scheikunde van het voormalige Ruud de Moor Centrum van de OU; zie ook de colofon in het arrangement voor toelichting. Samenvatting aan de hand van een paar zinnen met kernbegrippen: Een zuur is een deeltje dat een H+-ion kan afstaan, een base kan een H+-ion opnemen. De concentratie H3O+(aq)-ionen bepaalt de zuurgraad van een zure oplossing; de concentratie OH–(aq)-ionen bepaalt de basegraad van een basische oplossing. De zuurgraad en de basegraad van een oplossing drukken we uit in de pH. Deze kunnen we met een zuur-base-indicator bepalen. De pH van een oplossing kunnen we redelijk constant houden met een buffer. Bij een reactie tussen een zuur en een base treedt overdracht van een H+-ion op van het zuur naar de base.
- Leerniveau
- HAVO 4; VWO 6; HAVO 5; VWO 4; VWO 5;
- Leerinhoud en doelen
- Scheikunde; Reactiviteit;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 0 uur 50 minuten
- Trefwoorden
- basen, buffer, indicator, ph, protonacceptor, protonen, zuren, zuurconstante, zuurevenwicht, zuurgraad
Bronnen
| Bron | Type |
|---|---|
|
Het waterevenwicht. https://youtu.be/YSfeEeA6L8E |
Video |
|
Uitleg over de pH en pOH. https://youtu.be/11tIkTNXSYo |
Video |
|
De zuren. https://youtu.be/CRRkx8aWWBU |
Video |
|
Zure oplossingen. https://youtu.be/AVpGM_mcXxs |
Video |
|
Hoe gebruik je tabel 49 uit BINAS? https://youtu.be/0VmgAhnE-Z0 |
Video |
|
Basen en basische oplossingen. https://youtu.be/FlUfI9_Qm64?rel=0 |
Video |
|
Uitleg over amfolyten. https://youtu.be/yax9dgJ_z6I |
Video |
|
pH-berekening van een oplossing van een zwak zuur. https://youtu.be/v-pY1UmKWDY |
Video |
|
pH-berekening van een oplossing van zwakke base. https://youtu.be/E9P6ajVyz4Y |
Video |
|
Berekeningen van pH en de pOH. https://youtu.be/A_N7Es4XhSQ |
Video |
|
De verschillende zuur-base berekeningen worden behandeld. https://youtu.be/m5MxcCR8Ias |
Video |
|
Berekeningen met zuren en basen. https://youtu.be/k-iGJtnFOow |
Video |
|
Zuur-base indicatoren. https://youtu.be/Japbu8j9Frk |
Video |
|
Behandeling van de zuur- en baseconstante. https://youtu.be/amlVPzD4Hm4 |
Video |
|
Reacties tussen zuren en basen. https://youtu.be/cphTk-aHXPM |
Video |
|
Wanneer reageren zouten als zuur of als base? https://youtu.be/iTK5eHZ2AIs |
Video |
|
Reacties tussen zuren en basen. https://youtu.be/FwaHW8ceRPQ |
Video |
|
De buffers worden behandeld. https://youtu.be/TNYGxn_XhBk |
Video |
|
Uitleg over de pH-berekening van een bufferoplossing https://youtu.be/TmvKUb3CeA4 |
Video |
|
Hoe maak je een bufferoplossing van een bepaalde pH? https://youtu.be/K1Zm6i0L1qs |
Video |
Gebruikte Wikiwijs Arrangementen
Naafs, Dick. (z.d.).
SK-12 Toets zuren en base
Naafs, Dick. (z.d.).
SK-12 toets zuren en basen niveau vwo
https://maken.wikiwijs.nl/51409/SK_12_toets_zuren_en_basen_niveau_vwo
Naafs, Dick. (z.d.).
Toets naamgeving van zuren, basen en zouten
https://maken.wikiwijs.nl/48679/Toets_naamgeving_van_zuren__basen_en_zouten