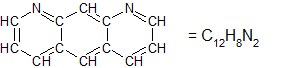
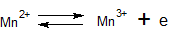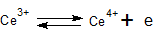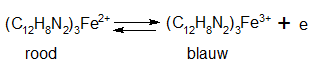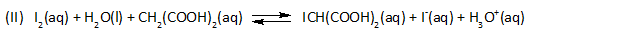Het arrangement Oscillerende reacties is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteurs
- Laatst gewijzigd
- 23-05-2013 11:32:24
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 3.0 Nederlands licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
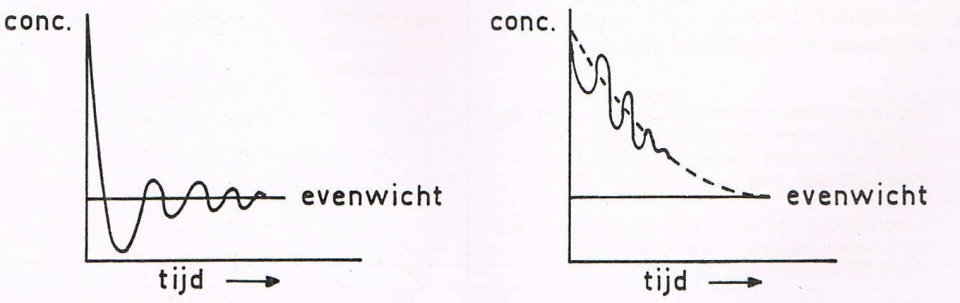
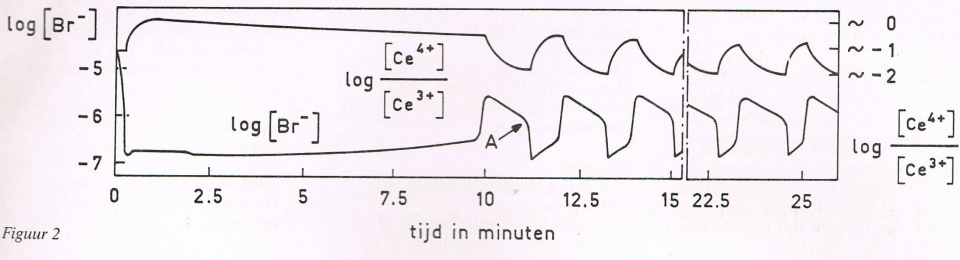
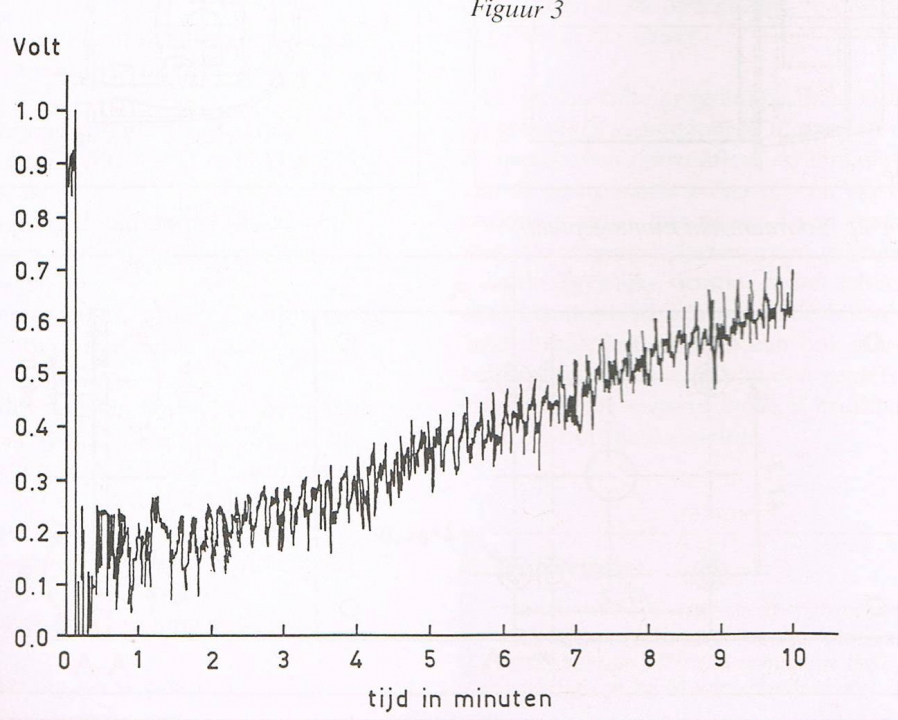
- Oscillerende reacties worden vaak genoemd als demonstratieproeven om verwondering te wekken voor scheikundige verschijnselen. De vele voorschriften voor oscillerende reacties blijken bij nader inzien variaties te zijn op twee basisreacties, namelijk die van Belousov-Zhabotinsky en die van Briggs-Rauscher. De laatste is een verbeterde versie uit één van de eerste publicaties over oscillerende reacties van Bray uit 1921.
- Leerniveau
- HAVO 4; VWO 6; HAVO; VWO; HBO; HAVO 5; HBO - Master; VWO 5; HBO - Bachelor;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leraar
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 0 uur 50 minuten
- Trefwoorden
- belousov, bray, briggs, evenwichten, klokreactie, onderzoeksvaardigheden, ontwerpvaardigheden, oscillerende reactie, rauscher, reactiesnelheid, reactiesnelheid en evenwichten, ris-publicatie, ris-publicatie xxxiii, toepassingen, zhabotinsky
Bronnen
| Bron | Type |
|---|---|
|
Voorbeeld van een oscillerende reactie https://youtu.be/tg9SRstGos4?rel=0 |
Video |
|
Versnelde B-Z reactie https://youtu.be/3JAqrRnKFHo?rel=0 |
Video |
|
https://youtu.be/CcBvzHkJYck?rel=0 https://youtu.be/CcBvzHkJYck?rel=0 |
Video |
|
http://ocw.mit.edu/jw-player-free/player.swf http://ocw.mit.edu/jw-player-free/player.swf |
Video |