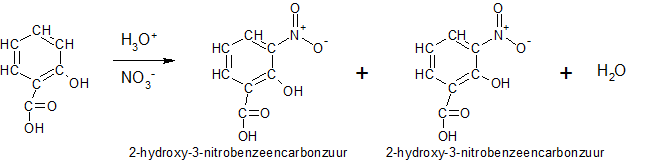
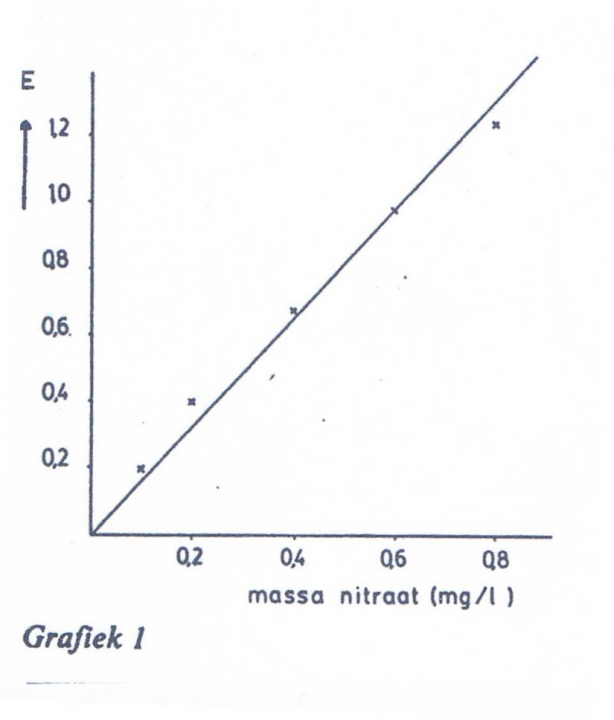
Het arrangement Bepaling van het nitraatgehalte in water is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 26-08-2019 13:39:16
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 3.0 Nederlands licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Met behulp van colorimetrie kan het nitraatgehalte in water worden bepaald.
- Leerniveau
- VWO 6; HBO; HAVO 5; HBO - Master; VWO 5; HBO - Bachelor;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leraar
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 0 uur 50 minuten
- Trefwoorden
- analysetechnieken, colorimetrie, nitraat, onderzoeksvaardigheden, ris-publicatie, ris-publicatie xxx, technisch-instrumentele vaardigheden, water