Het arrangement Sk-09 Zouten is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteurs
- Laatst gewijzigd
- 02-02-2016 22:13:23
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 3.0 Nederland licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie.
Vakinhoudelijk deel van een thema over zouten, omgezet in een Wikiwijs arrangement vanuit een prototype van een kennisbank scheikunde van het voormalige Ruud de Moor Centrum van de OU. Oorspronkelijke auteurs en samenstellers van de kennisbank: Jan de Dobbelaere, Ingrid Holtkamp en Jan Lutgerink. Aanpassingen door Dick Naafs en Jan Lutgerink.
We werken de kennisbank sinds 2010 niet meer bij, maar we doen dit wel voor thema's die we hebben omgezet in Wikiwijs arrangementen. U kunt mailen naar Jan Lutgerink als u voorstellen heeft voor aanpassing, maar u kunt ook een kopie van het arrangement maken om het zelf aan te passen of uit te breiden voor gebruik in de les of voor zelfstudie door leerlingen. In een digitale handleiding kunt u zien hoe u dat moet doen.
De kennisbank is ooit opgezet voor ondersteuning van beginnende docenten scheikunde. Ze bestond ook uit meerdere kennislagen: vakinhoud, vakdidactiek, toetsen, etc. De vakinhoud beschreven we als minimale parate kennis die een beginnend docent moet hebben om het vak te kunnen geven. Daaraan koppelden we didactische aanwijzingen en - waar relevant - kennis over preconcepten en misconcepten bij leerlingen.
Sommige teksten zijn wellicht ook voor leerlingen geschikt, maar dat was niet de opzet van de kennisbank. We laten het aan de docent(e) over of dit materiaal geschikt is voor bijvoorbeeld zelfstudie van zijn/haar leerlingen.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
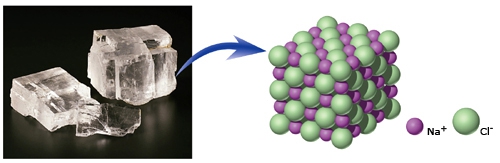
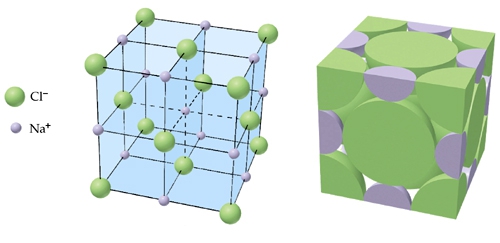
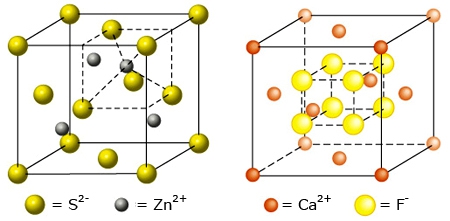
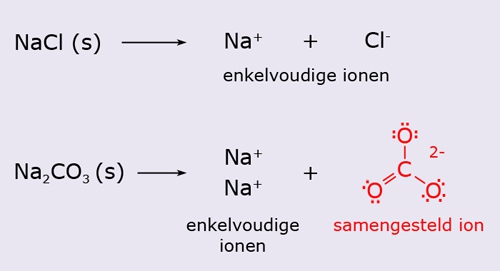
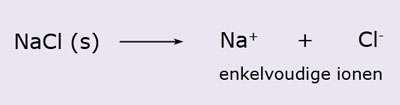
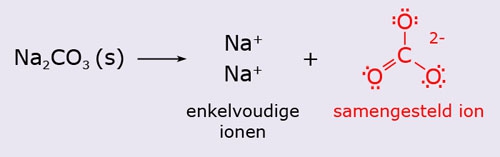
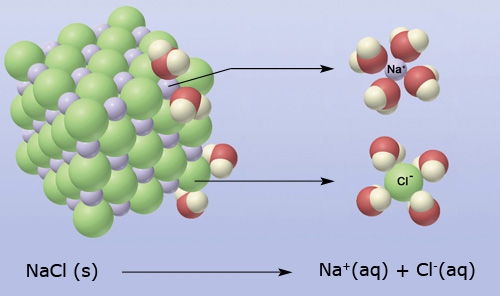
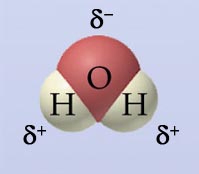
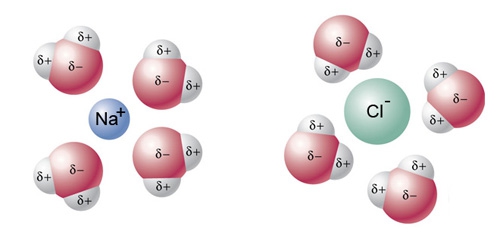
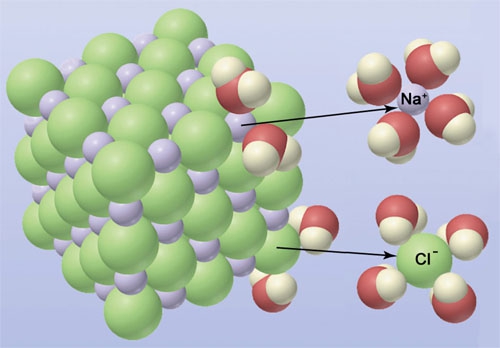
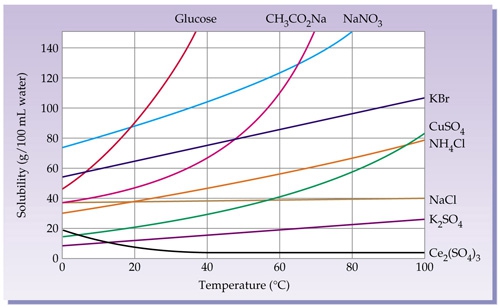
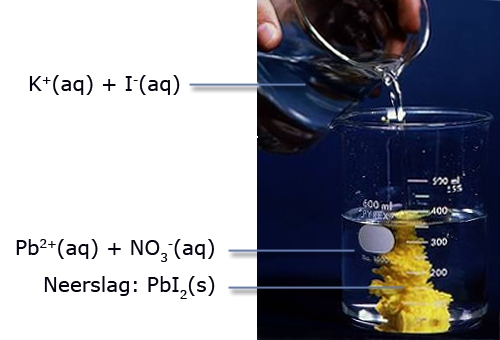
- Vakinhoudelijk deel van een thema over zouten, omgezet in een Wikiwijs arrangement vanuit een prototype van een kennisbank scheikunde van het voormalige Ruud de Moor Centrum van de OU; zie ook de colofon in het arrangement voor toelichting. Samenvatting: Zouten zijn opgebouwd uit positieve en negatieve ionen, die regelmatig zijn gerangschikt in een ionrooster. Een ionbinding houdt de ionen bijeen, maar een zout splitst in ionen als het oplost. De ionen bewegen zich vrij door het oplosmiddel, waardoor een zoutoplossing een goede stroomgeleider is. Bij het mengen van twee verschillende zoutoplossingen kunnen positieve en negatieve ionen bij elkaar komen die samen een slecht oplosbaar zout vormen; er ontstaat een neerslag. Van deze kennis maken we gebruik bij de ontharding van water, en bij de synthese, zuivering en analyse van zouten.
- Leerniveau
- VMBO gemengde leerweg, 2; VMBO kaderberoepsgerichte leerweg, 1; VWO 2; VO; VMBO kaderberoepsgerichte leerweg, 2; VMBO basisberoepsgerichte leerweg, 4; VMBO gemengde leerweg, 3; VMBO basisberoepsgerichte leerweg, 1; VMBO theoretische leerweg, 1; HAVO 4; HAVO 1; VMBO theoretische leerweg, 4; VWO 6; VMBO gemengde leerweg, 1; VMBO theoretische leerweg, 2; VMBO basisberoepsgerichte leerweg, 2; VWO 1; HAVO 3; VWO 3; HAVO 5; Praktijkonderwijs; VWO 4; VMBO theoretische leerweg, 3; VMBO basisberoepsgerichte leerweg, 3; VMBO kaderberoepsgerichte leerweg, 4; HAVO 2; VMBO gemengde leerweg, 4; VWO 5; VMBO kaderberoepsgerichte leerweg, 3;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leraar
- Moeilijkheidsgraad
- gemiddeld
- Trefwoorden
- analyse, arrhenius, blijvende hardheid, chemie, complex ion, complexe ionen, coulomb, coulombkracht, dielektricum, dielektrische constante, dipoolmoleculen, dipoolmolecuul, edta, elektrische geleiding, elektronegatief, elektronegativiteit, elektrovalentie, elektrovalenties, elementaire ladingseenheden, elementaire ladingseenheid, enkelvoudig ion, enkelvoudige ionen, evenwichtsconstante, formule, gehydrateerd, geleidingsvermogen, gips, hard water, hardheid, hardheidsgraad, hydraat, hydraatvorming, hydratatie, hydraten, hygroscopisch, hygroscopisch zout, hygroscopische zouten, indampen, indampvergelijking, ion, ion-dipoolbinding, ionbinding, ionen, ionenwisselaar, ionlading, ionladingen, ionmassa, ionogene stof, ionrooster, kalkaanslag, kalksteen, ketelsteen, keukenzout, keukenzoutkristal, kristal, kristalsoda, kristalstructuur, kristalwater, kunsthars, ladingseenheden, ladingseenheid, metaalion, metaalionen, metaaloxide, metaaloxiden, micel, micellen, natriumchloride, neerslag, neerslagreactie, neerslagreacties, negatief ion, negatieve ionen, niet-metaalion, niet-metaalionen, onoplosbaar, onoplosbaar zout, onoplosbare zouten, ontharden, ontharding, oplosbaar, oplosbaar zout, oplosbaarheid, oplosbaarheidsproduct, oplosbaarheidsregel, oplosbaarheidsregels, oplosbaarheidstabel, oplosbare zouten, oplosmiddel, oplosmiddelen, oplosmiddelmoleculen, oplosmiddelmolecuul, oplossing, oplossingen, oplosvergelijking, overmaat, polair, polair oplosmiddel, polariteit, positief ion, positieve ionen, ruimtelijke bouw, ruimtelijke structuurformule, ruimtelijke voorstelling, samengesteld ion, samengestelde ionen, scheikunde, solvatatie, stroomdoorgang, stroomgeleider, stroomgeleiding, structuur, synthese, tijdelijke hardheid, triviale naam, triviale namen, valentie, valenties, verhoudingsformule, wasmiddel, watermoleculen, watermolecuul, wet van coulomb, zacht water, zeep, zeepwerking, zout, zouten, zouthydraat, zouthydraten, zoutkristal, zoutoplossing, zoutoplossingen, zuivering
Bronnen
| Bron | Type |
|---|---|
|
Zouten (1) https://youtu.be/DhWmWOL_ch8?rel=0 |
Video |
|
Zouten (2) https://youtu.be/HrAGkD9bHYU?rel=0 |
Video |
|
zouten (3) https://youtu.be/QQPKgk58ULQ?rel=0 |
Video |
|
metaaloxiden: oplosbaarheid https://youtu.be/Adx0rDPC1RA?rel=0 |
Video |
|
Proefje: vorming van lood(II)jodide. https://youtu.be/khZIl9kv5Xc?rel=0 |
Video |
|
zouten (4) https://youtu.be/QQPKgk58ULQ |
Video |
|
Neerslagreacties deel 1 https://youtu.be/X50rye03kBo?rel=0 |
Video |
|
Neerslagreacties deel 2 https://youtu.be/gjw9-1n0rqk?rel=0 |
Video |
|
Wat is hard water? https://youtu.be/Z2IDakz7I60?rel=0 |
Video |
|
hydraten en kristalwater https://youtu.be/nwkJNdZIOOk?rel=0 |
Video |
|
Samenvatting https://youtu.be/gOJ5plnOQdc?rel=0 |
Video |
Gebruikte Wikiwijs Arrangementen
Naafs, Dick. (z.d.).
Sk-09 Toets zouten 4/5 havo
Naafs, Dick. (z.d.).
Sk-09 Toets zouten 4/5 vwo