Het arrangement MAVO scheikunde is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 13-10-2022 12:26:43
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Alle stof om je MAVO eindexamen scheikunde te kunnen maken
- Leerniveau
- VMBO theoretische leerweg, 4; VMBO theoretische leerweg, 3;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld


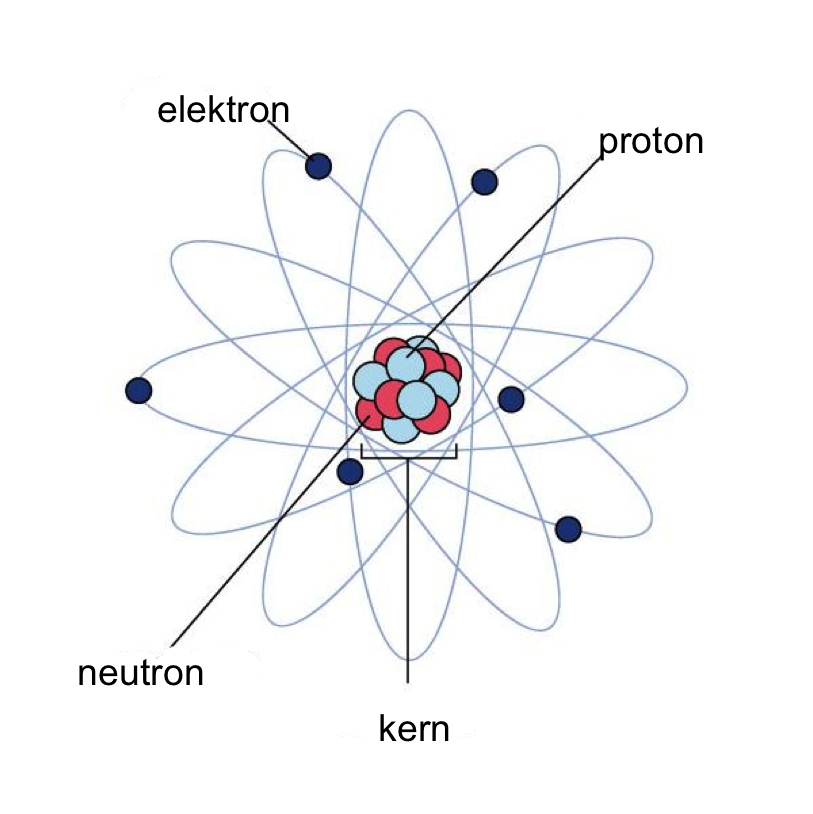
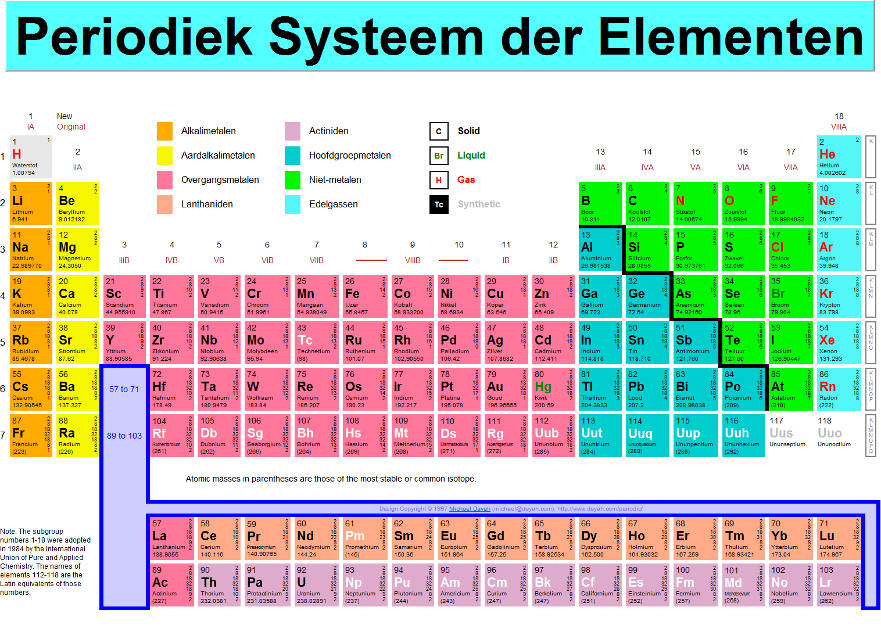
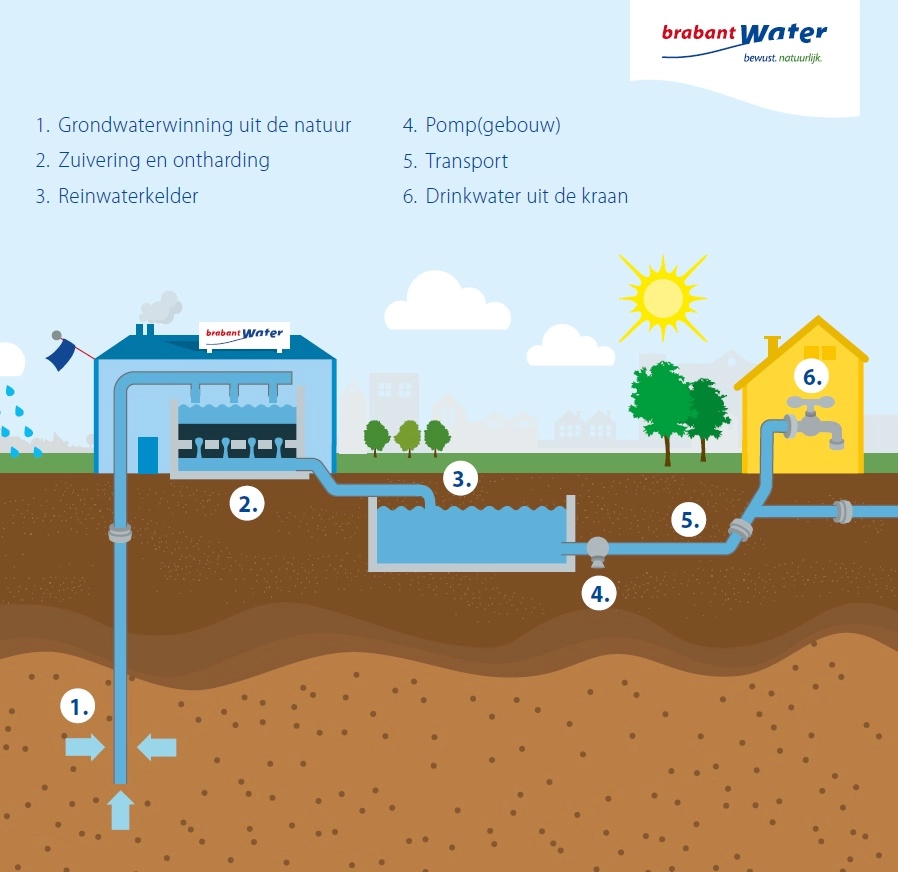 Het is erg belangrijk dat je schoon water drinkt, anders kan je ziek worden (dit gebeurde vroeger erg vaak). Als je drinkwater uit grondwater maakt, hoef je het niet erg te filteren aangezien er niet veel andere stoffen in zitten.
Het is erg belangrijk dat je schoon water drinkt, anders kan je ziek worden (dit gebeurde vroeger erg vaak). Als je drinkwater uit grondwater maakt, hoef je het niet erg te filteren aangezien er niet veel andere stoffen in zitten.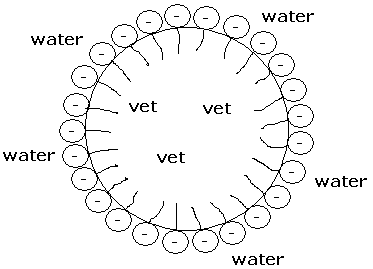 Dit is een micel. Dit is een kleine structuur van veel zeepmoleculen van bijvoorbeeld olie in water. Olie en water mengen niet met elkaar, maar doordat de watermoleculen zich aan de kop en olie aan de staart binden, ontstaat er een emulsie. Zeep wordt daarom ook wel een emulgator genoemd.
Dit is een micel. Dit is een kleine structuur van veel zeepmoleculen van bijvoorbeeld olie in water. Olie en water mengen niet met elkaar, maar doordat de watermoleculen zich aan de kop en olie aan de staart binden, ontstaat er een emulsie. Zeep wordt daarom ook wel een emulgator genoemd. 
