Het arrangement Thema: Groene Chemie hv3 - kopie 1 is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteurs
- Laatst gewijzigd
- 22-11-2021 09:51:28
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Colofon
De module Groene Chemie is ontwikkeld door Sander Bons en medewerkers van StudioVO op basis van materiaal van xxxxxxxxxxxxxxxxxx.
Bij het ontwikkelen van het materiaal is gebruik gemaakt van of wordt verwezen naar materiaal van de volgende websites:
Fair Use
In de Stercollecties van StudioVO wordt gebruik gemaakt van beeld- en filmmateriaal dat beschikbaar is op het internet. Bij het gebruik zijn we uitgegaan van fair use.
Meer informatie: Fair use .
Mocht u vragen/opmerkingen hebben,
neem dan contact op via de helpdesk VO-Content .
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Leerniveau
- HAVO 3; VWO 3;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 10 uur 0 minuten
- Trefwoorden
- arrangeerbaar, arrangeerbare, leerlijn, rearrangeerbare
Bronnen
| Bron | Type |
|---|---|
|
Uitleg begrippen atoomeconomie, rendement en E-factor. https://youtu.be/Fr1i6Q9EVmw |
Link |
|
Uitleg rekenen met vormingswarmtes https://youtu.be/wDTP7hN-Q_k |
Link |
Gebruikte Wikiwijs Arrangementen
VO-content Scheikunde. (2016).
Thema: Groene Chemie hv3

 Inleiding
Inleiding






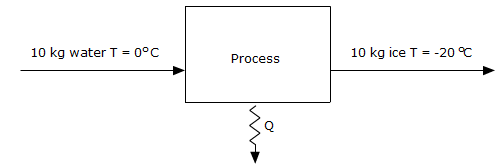
 Stollen van het water tot ijs:
Stollen van het water tot ijs: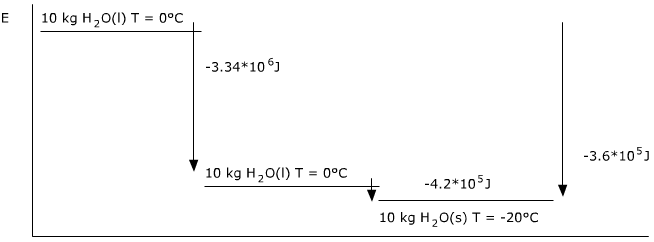


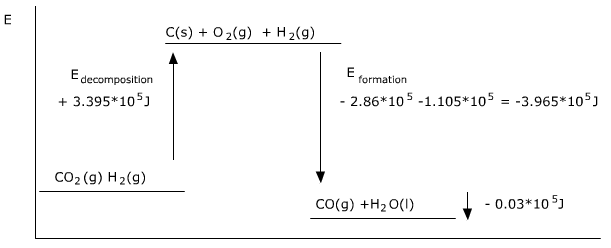
 C(s)+2H2(g)→CH4(g)C(s)+2H2(g)→CH4(g)
C(s)+2H2(g)→CH4(g)C(s)+2H2(g)→CH4(g)

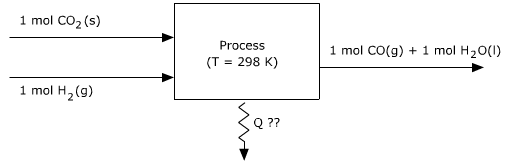
 Stap 2 - Stoffen
Stap 2 - Stoffen