Het arrangement Scheikunde Drenthe College is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 02-07-2020 09:49:25
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Hierin vind je lesmaterialen die worden gebruikt om je voorkennis op de frissen en uit te breiden voor scheikunde.
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 4 uur 0 minuten
Bronnen
| Bron | Type |
|---|---|
|
Omrekenen van eenheden https://www.youtube.com/watch?v=wvDescn7acA |
Video |
|
Dichtheid https://www.youtube.com/watch?v=ilKA_zVk7Rg |
Video |
|
Massa en volumepercentage https://www.youtube.com/watch?v=XHu7F0yScA4 |
Video |
|
Rekenvoorbeelden met ADI-waarde https://www.youtube.com/watch?v=bYKvJ-WMiPs |
Video |
|
Verbranding van magnesium https://www.youtube.com/watch?v=2M0nQr6cXoI |
Video |
|
Reactiesnelheid https://www.youtube.com/watch?v=93WDp-VN2z8&t=131s |
Video |
|
Kloppend maken van reactievergelijkingen https://www.youtube.com/watch?v=wXc_qfqPSfM |
Video |
|
Brand https://www.youtube.com/watch?v=hwn0TIX_rfI |
Video |
|
Wat is koolstofmonoxide? En waarom is het gevaarlijk? https://www.youtube.com/watch?v=IEf2u1vGd0w |
Video |
|
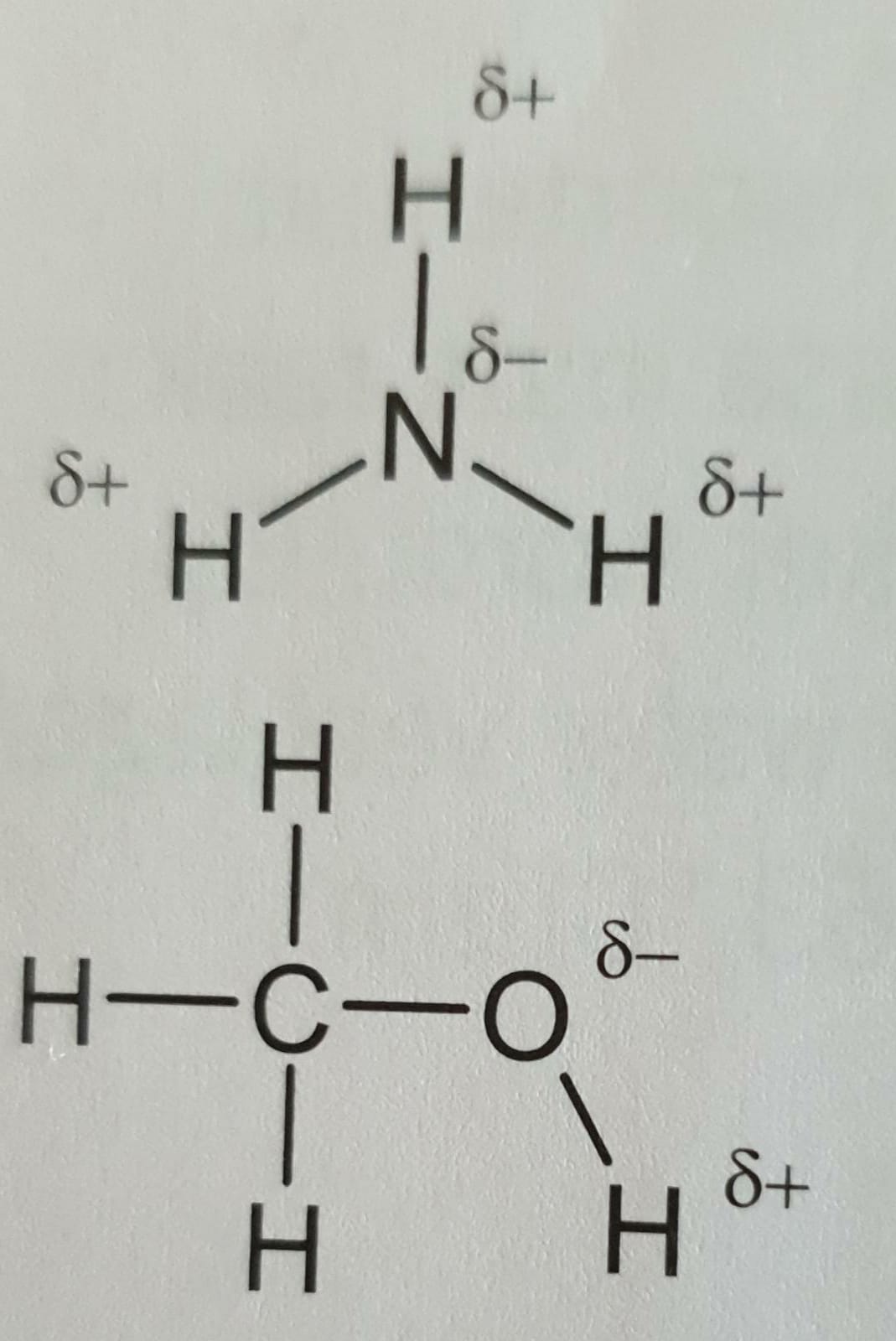
Vanderwaalsbinding https://www.youtube.com/watch?v=AYO9xquKHPg |
Video |
|
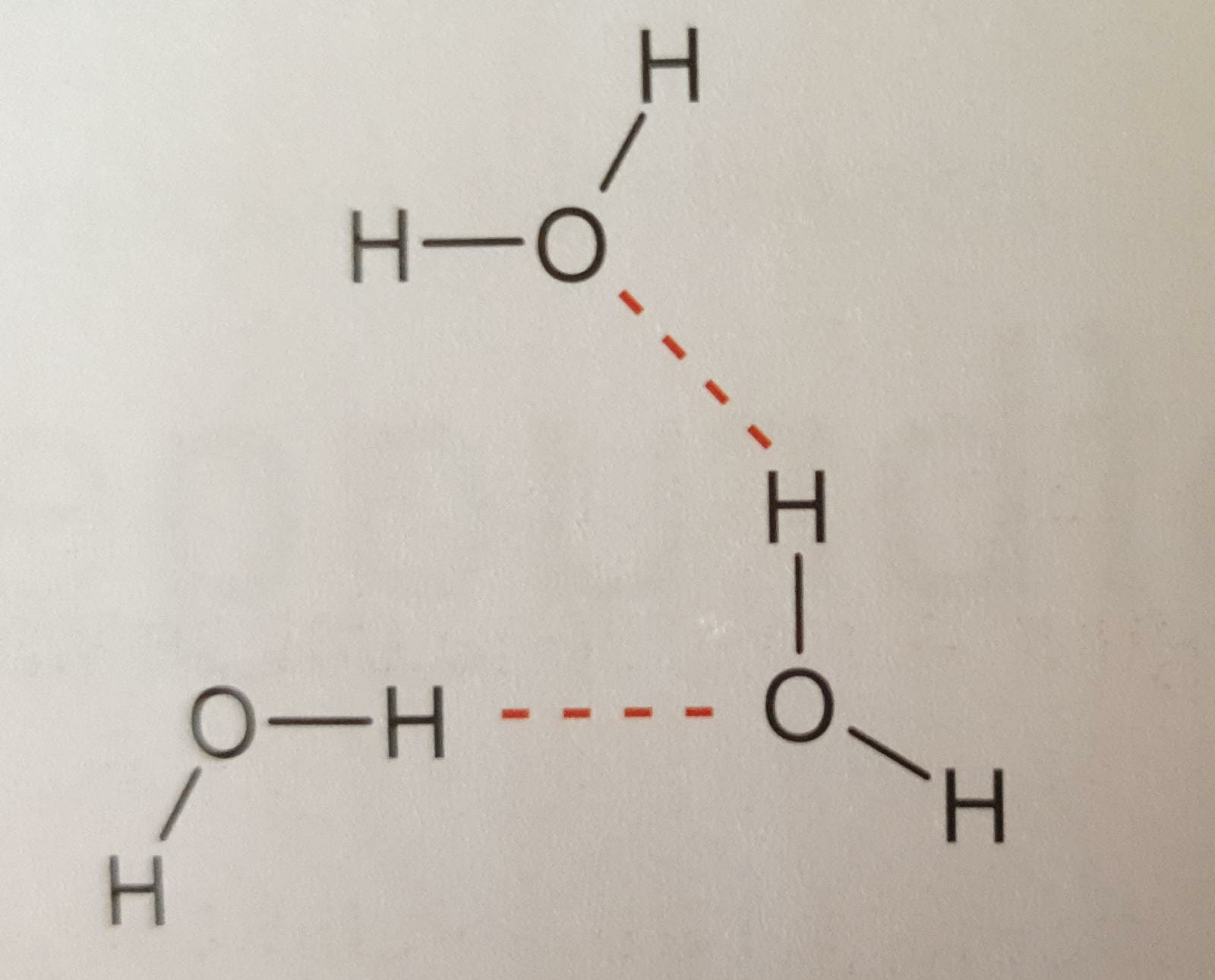
Waterstofbruggen https://www.youtube.com/watch?v=o4iQ2zlG0Vs |
Video |



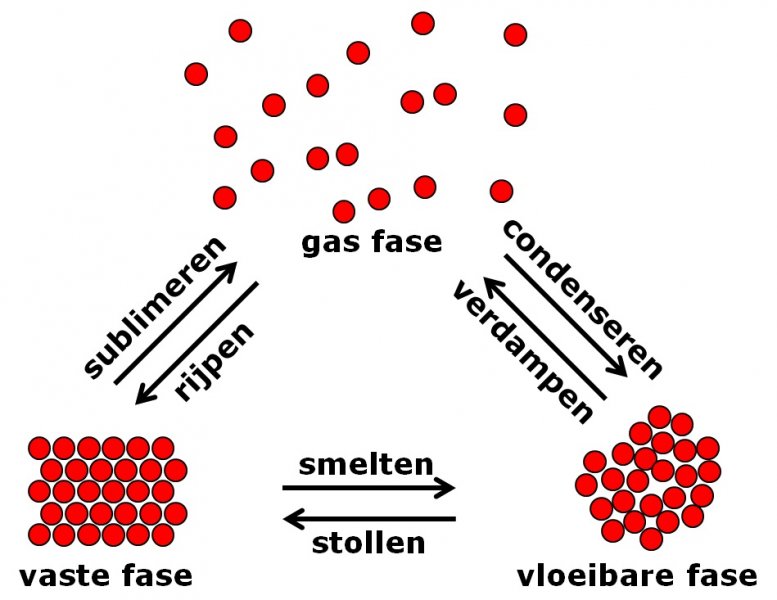
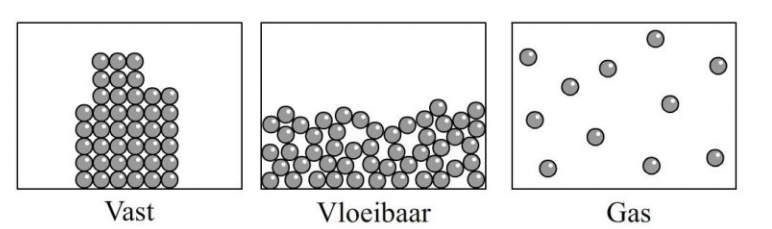
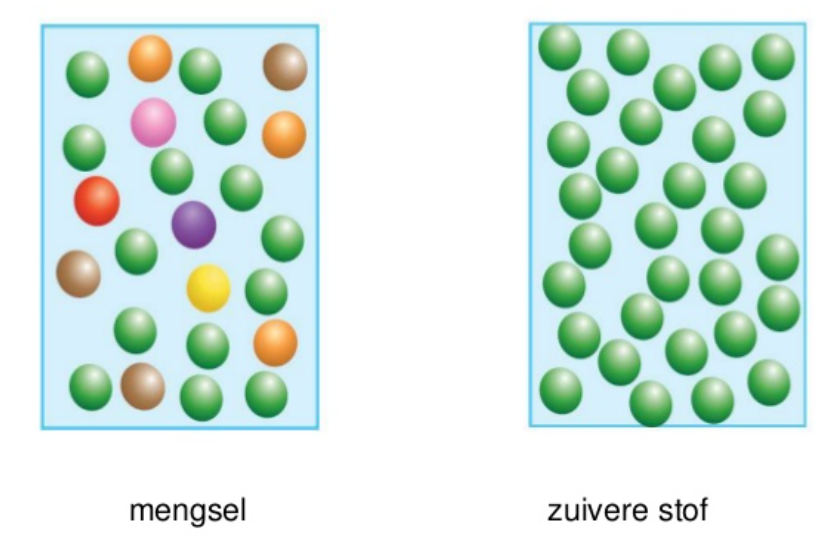
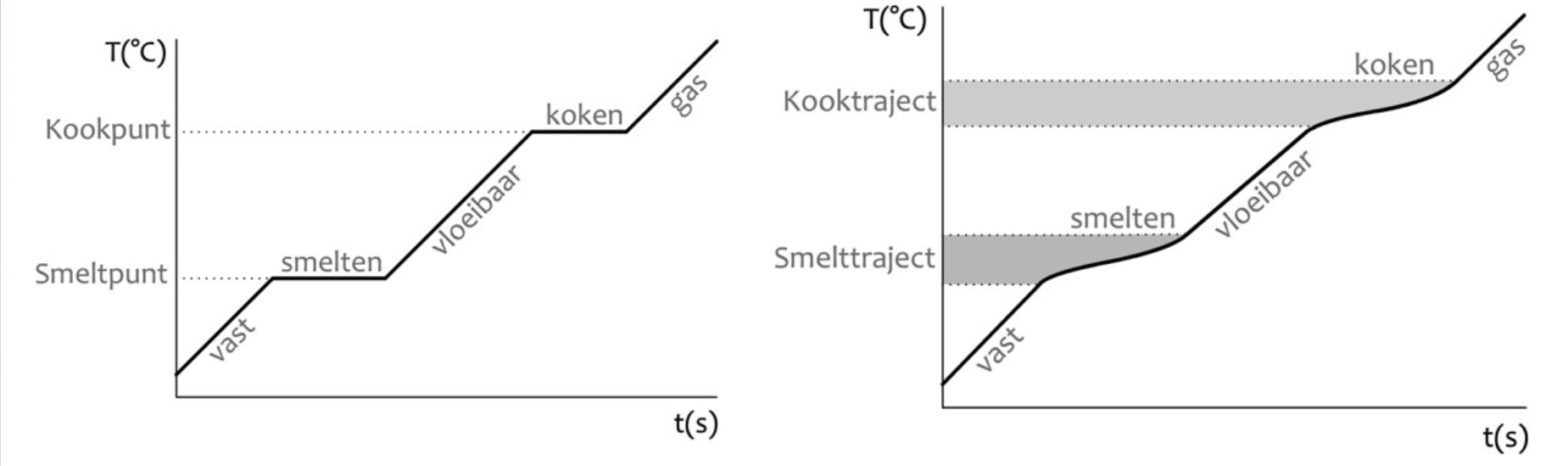


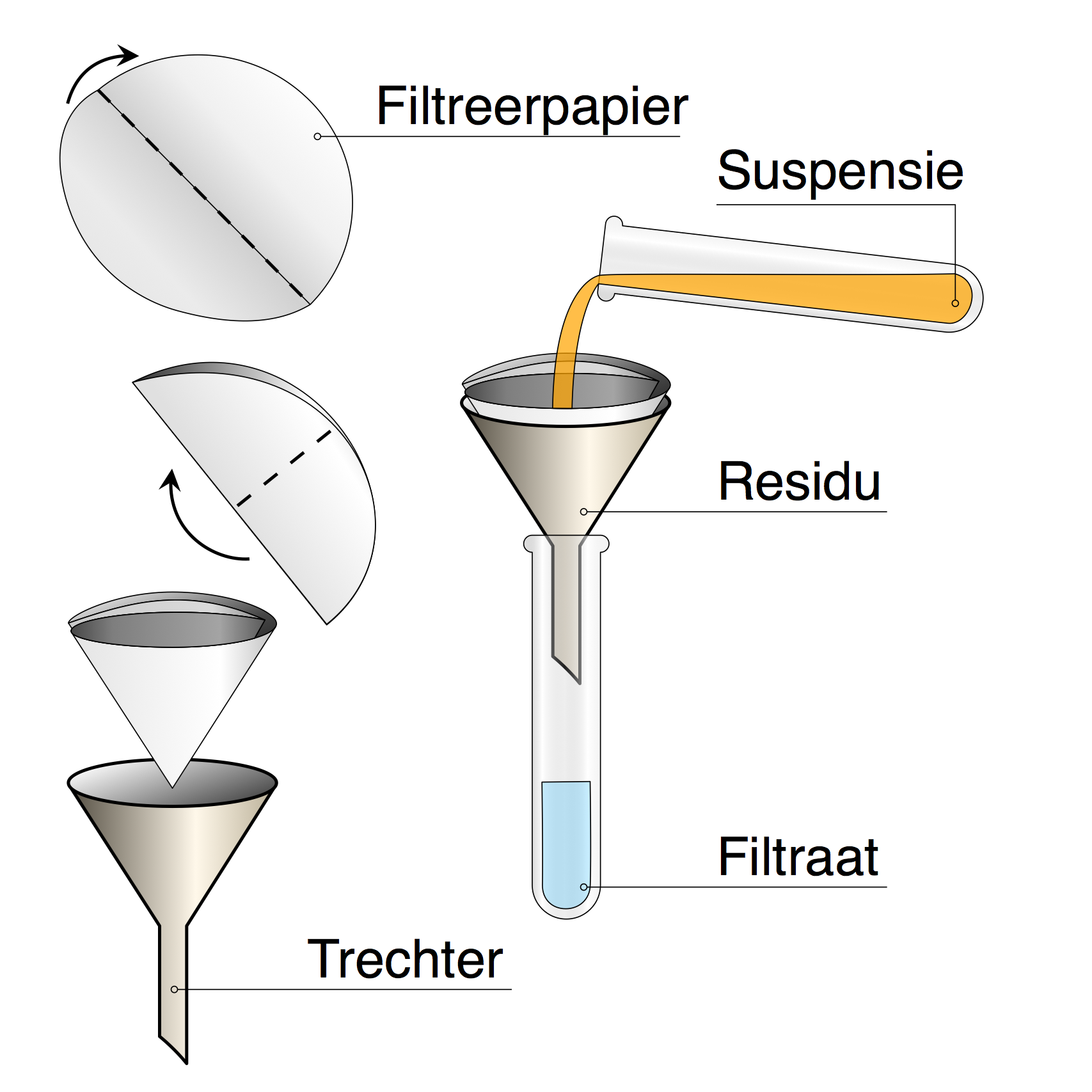
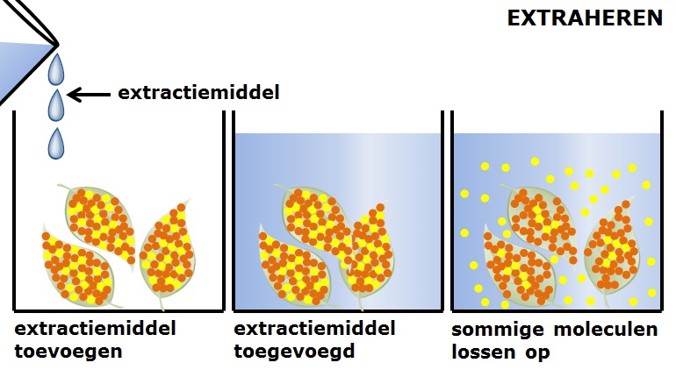

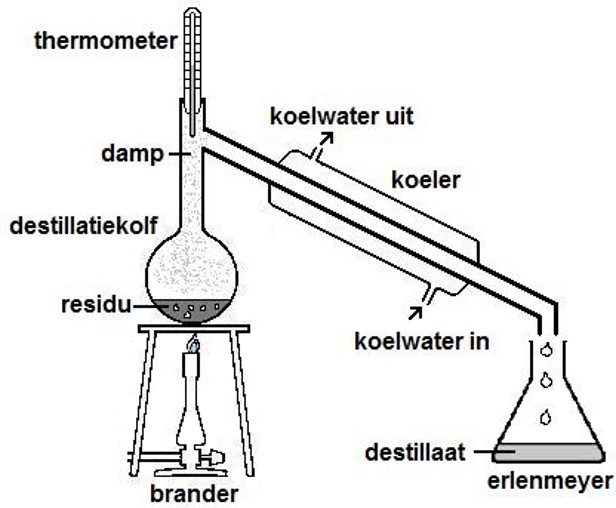
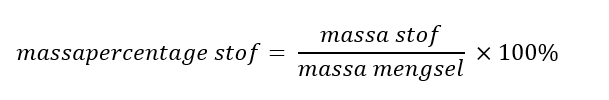
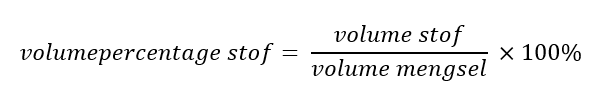

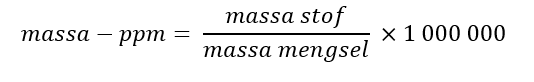


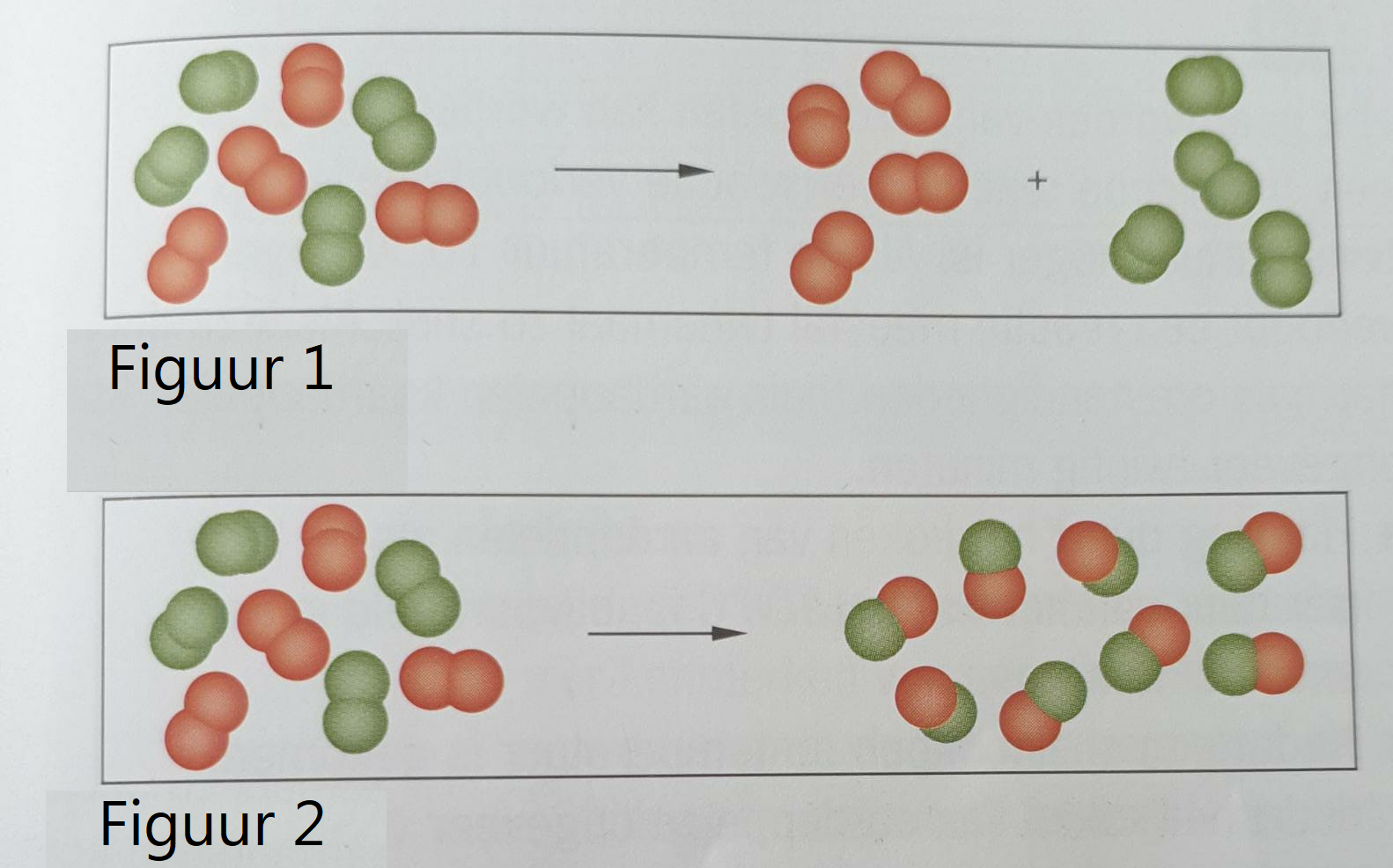

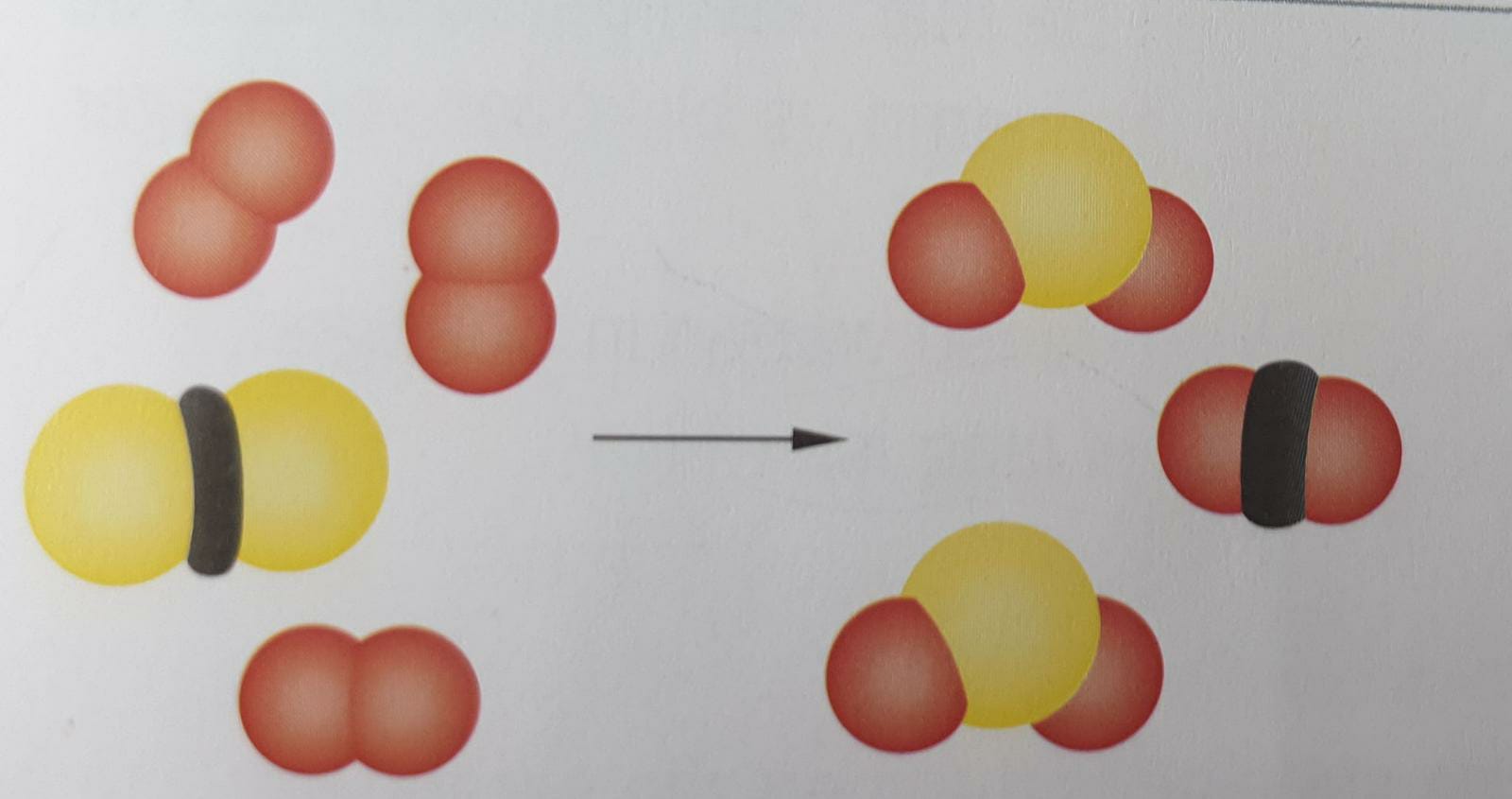

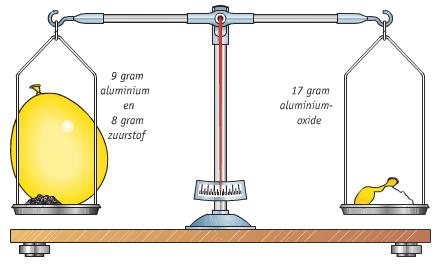

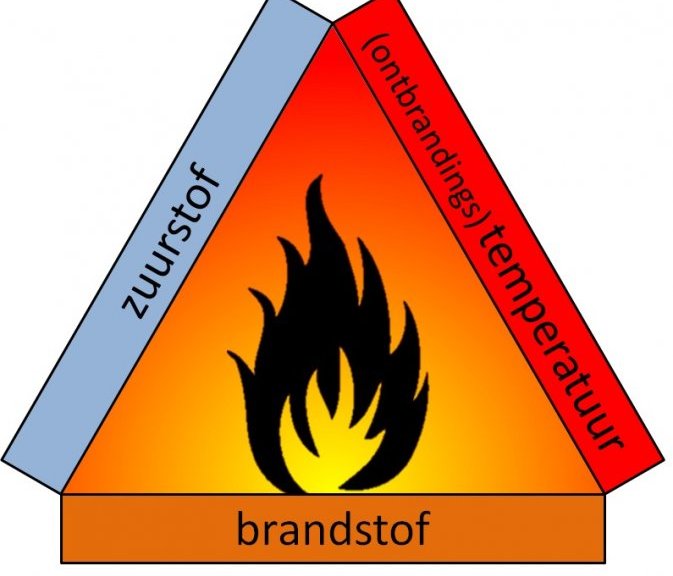 De branddriehoek met de drie voorwaarden voor verbranding
De branddriehoek met de drie voorwaarden voor verbranding