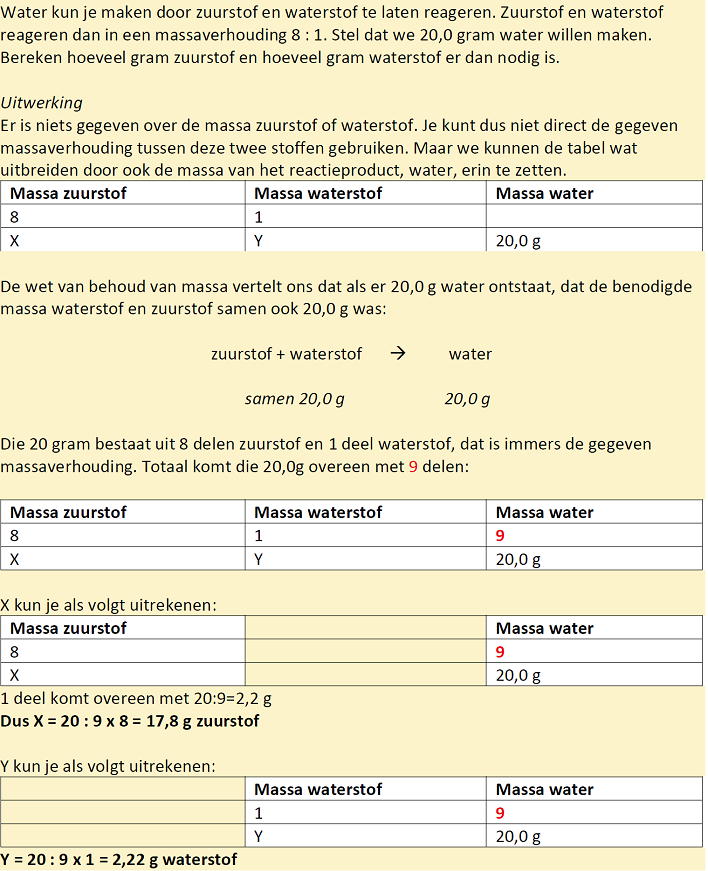
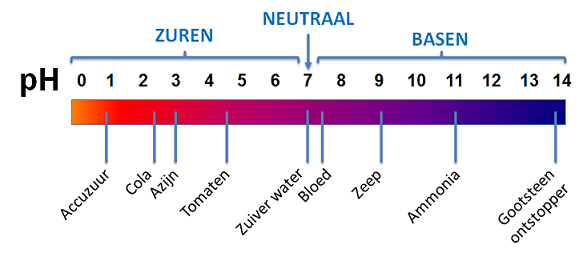
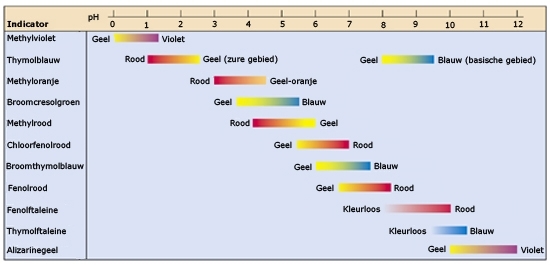
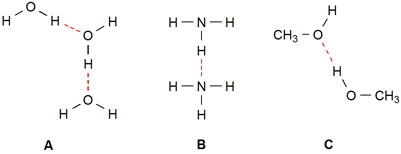
Het arrangement Kennisbank scheikunde klas 3 is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteurs
- Laatst gewijzigd
- 24-10-2020 23:42:34
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Online kennisbank waarin leerlingen uit havo 3 en vwo 3 zelf uitleg kunnen vinden over de theorie bij het van scheikunde
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
Bronnen
Gebruikte Wikiwijs Arrangementen
Vredenburg, Galvin. (z.d.).
Fasen & faseovergangen - kopie 1
https://maken.wikiwijs.nl/152168/Fasen___faseovergangen___kopie_1


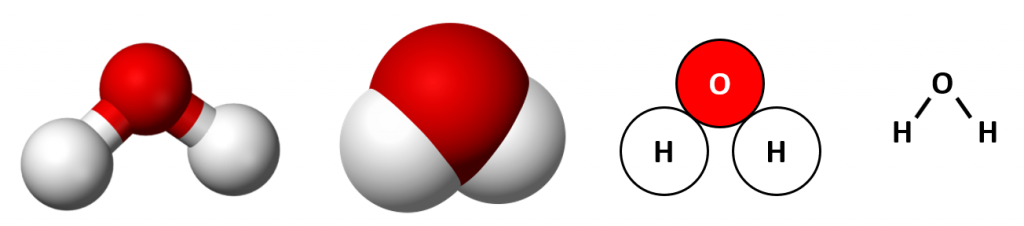
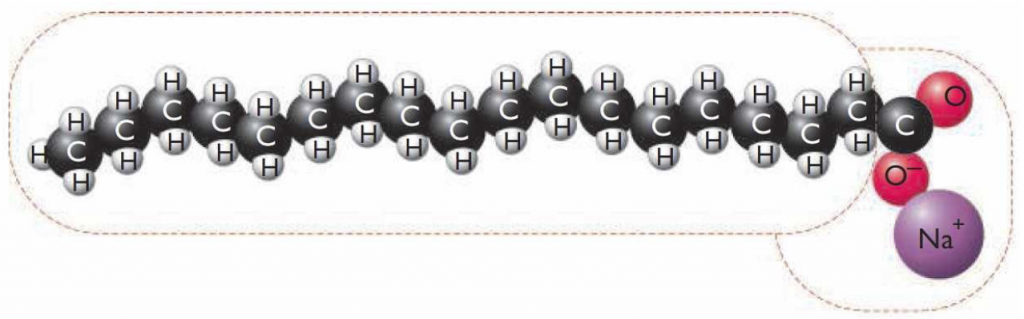
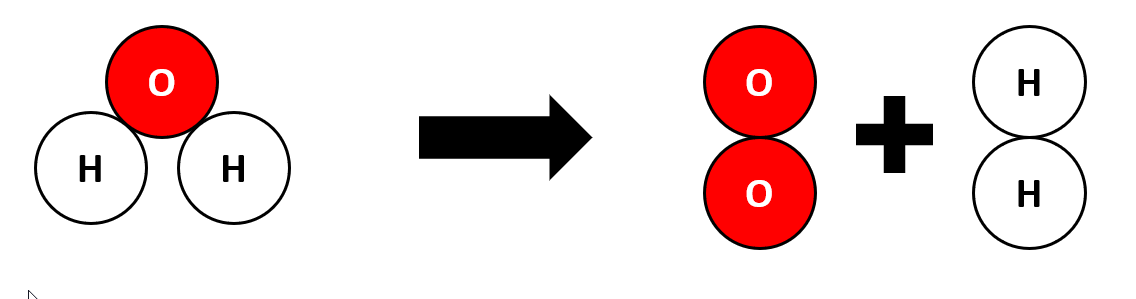
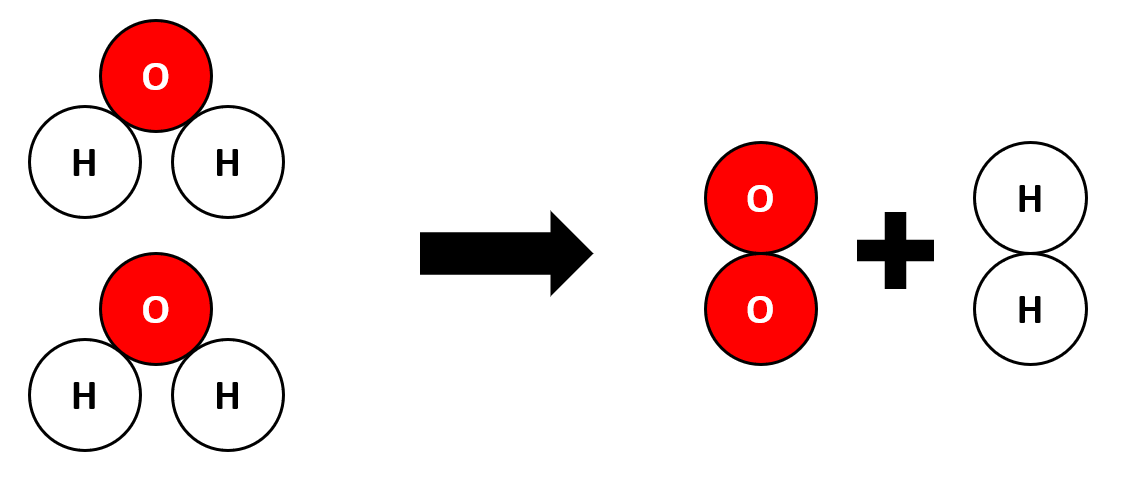
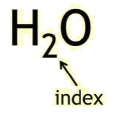 Waarschijnlijk heb je ooit wel eens gehoord van de molecuulformule van water: H2O. Maar wat betekent dit nu eigenlijk? Een molecuulformule geeft aan welke atoomsoorten er in een molecuul zitten, en hoeveel van deze soort. Water bevat twee waterstofatomen en één zuurstofatoom. Het kleine cijfer 2 in de formule na het symbool H geeft dus weer dat er 2 atomen van deze soort in het molecuul zitten. Dit cijfer noemen we de index. De index ‘1’ wordt nooit geschreven; staat er dus niets achter een symbool in de formule dan komt er maar 1 atoom van deze soort voor in het molecuul.
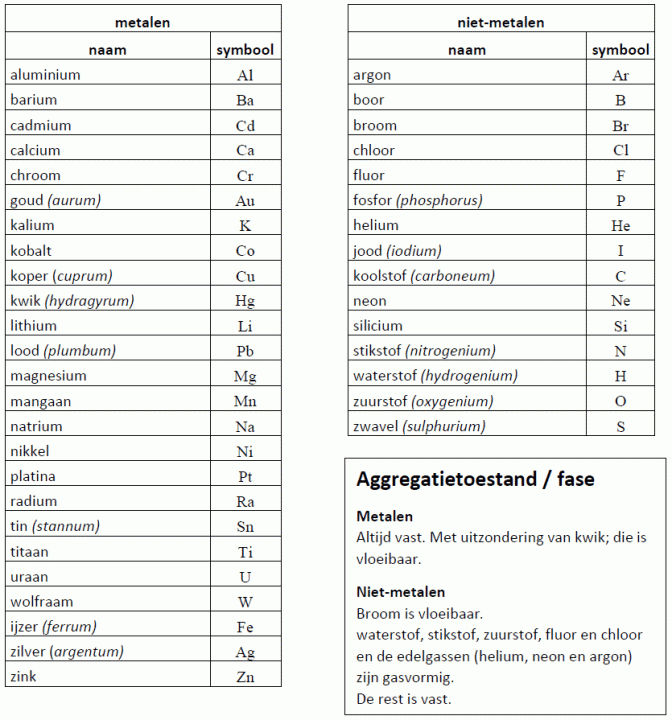
Waarschijnlijk heb je ooit wel eens gehoord van de molecuulformule van water: H2O. Maar wat betekent dit nu eigenlijk? Een molecuulformule geeft aan welke atoomsoorten er in een molecuul zitten, en hoeveel van deze soort. Water bevat twee waterstofatomen en één zuurstofatoom. Het kleine cijfer 2 in de formule na het symbool H geeft dus weer dat er 2 atomen van deze soort in het molecuul zitten. Dit cijfer noemen we de index. De index ‘1’ wordt nooit geschreven; staat er dus niets achter een symbool in de formule dan komt er maar 1 atoom van deze soort voor in het molecuul.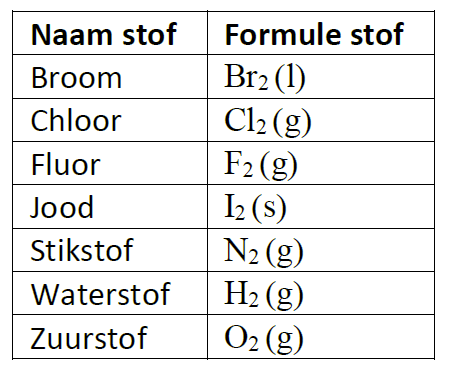 De molecuulformule van een niet-ontleedbare stof bevat altijd maar één atoomsoort! Bijna altijd is de formule dan ook gewoon het symbool van het atoomsoort. Zo noteren we als formule van de stof ijzer 'Fe', en van de stof neon 'Ne'.
De molecuulformule van een niet-ontleedbare stof bevat altijd maar één atoomsoort! Bijna altijd is de formule dan ook gewoon het symbool van het atoomsoort. Zo noteren we als formule van de stof ijzer 'Fe', en van de stof neon 'Ne'.
 Video-uitleg over filtreren
Video-uitleg over filtreren

 We kunnen deze drie benodigdheden voor brand weergeven in de branddriehoek. Deze staat hiernaast afgebeeld.
We kunnen deze drie benodigdheden voor brand weergeven in de branddriehoek. Deze staat hiernaast afgebeeld.