Het arrangement Ionaire stoffen (zouten) is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 13-11-2019 14:55:33
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Binnen de scheikunde delen we stoffen in drie soorten op; moleculaire stoffen, metalen en zouten. In dit hoofdstuk gaan we dieper in op de zouten (ionaire stoffen).
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Trefwoorden
- elektrovalentie, geleidbaarheid, hydraten, ionen, ionrooster, neerslag, oplosbaarheid, zouten, zoutformule


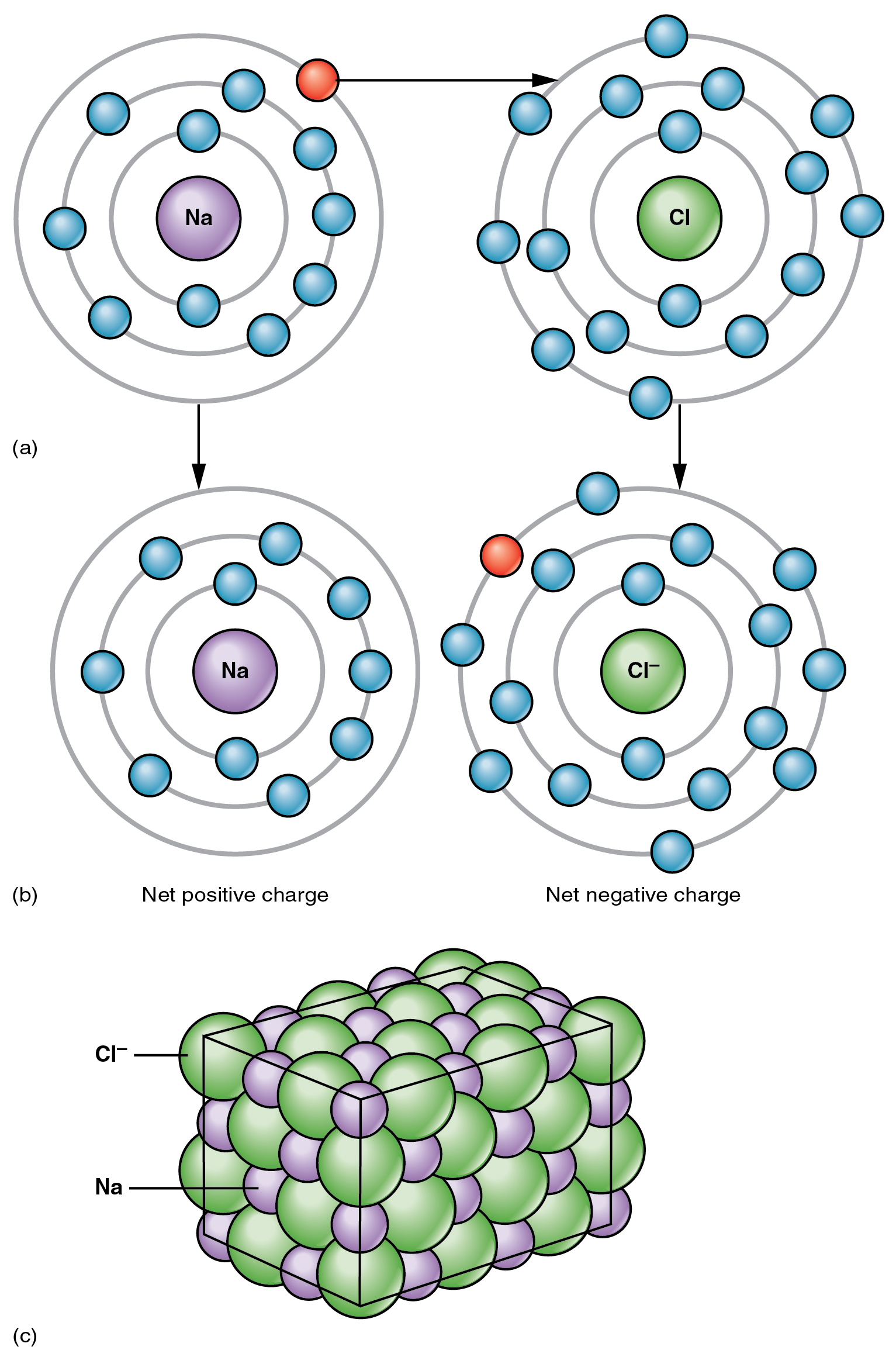
 In de opgave staan steeds zouten benoemd.
In de opgave staan steeds zouten benoemd.
 mensen die er wonen). De schadelijke effecten van zouten kun je herleiden tot de eigenschappen van de afzonderlijke ionen. Het zijn vooral positieve ionen waar we mee op moeten passen in het milieu. De ionen van “zware metalen”, zoals kwik, lood, barium, chroom, zijn regelrecht giftig. Bij de meeste andere ionen ligt het wat genuanceerder; pas bij grotere concentraties leiden ze tot vervelende gevolgen. De ionsoorten nitraat, fosfaat, kalium en ammonium hebben een gunstig effect op de groei van planten (kunstmest!). Maar bij een teveel raken de natuurlijke evenwichten verstoord. De aanwezigheid van natriumchloride in water dat in de zee wordt geloosd is geen probleem, maar ons rivierwater moet geschikt blijven voor flora en fauna, voor drinkwater en voor de landbouw.
mensen die er wonen). De schadelijke effecten van zouten kun je herleiden tot de eigenschappen van de afzonderlijke ionen. Het zijn vooral positieve ionen waar we mee op moeten passen in het milieu. De ionen van “zware metalen”, zoals kwik, lood, barium, chroom, zijn regelrecht giftig. Bij de meeste andere ionen ligt het wat genuanceerder; pas bij grotere concentraties leiden ze tot vervelende gevolgen. De ionsoorten nitraat, fosfaat, kalium en ammonium hebben een gunstig effect op de groei van planten (kunstmest!). Maar bij een teveel raken de natuurlijke evenwichten verstoord. De aanwezigheid van natriumchloride in water dat in de zee wordt geloosd is geen probleem, maar ons rivierwater moet geschikt blijven voor flora en fauna, voor drinkwater en voor de landbouw.

