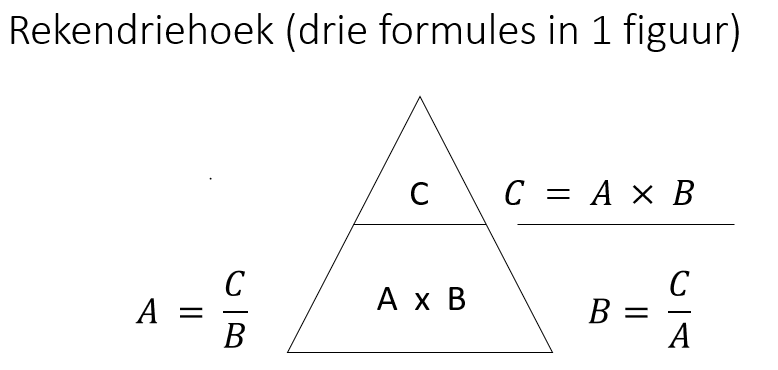
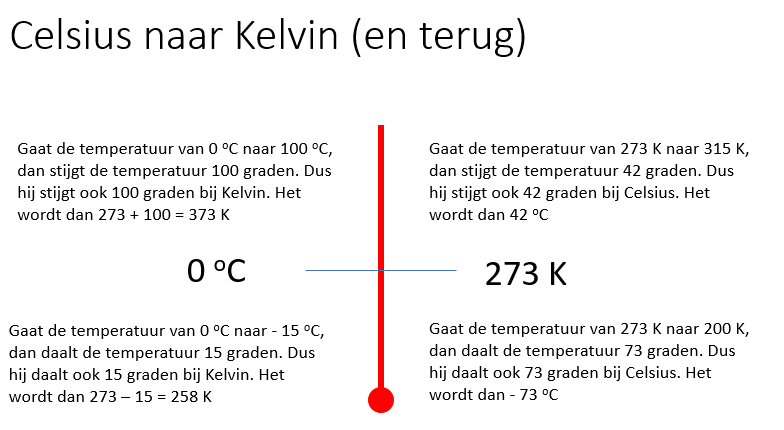
Het arrangement 2019-2020 Mavo 4 nask 1 Tentamen 2 is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteurs
- Laatst gewijzigd
- 03-09-2019 11:00:08
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 4.0 Internationale licentie.
Dit materiaal is vrij te gebruiken. Gebruik het goed ter eigen ontwikkeling of ter ontwikkeling van leerlingen.
Succes en met vriendelijke groet,
Remco de Jong

Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Stof en werkvormen om je voor te bereiden op je tentamen 2 voor het vak nask 1 (= natuurkunde)
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld

Bronnen
| Bron | Type |
|---|---|
|
Warm hè https://www.youtube.com/watch?v=cfIaRpmPL2Y |
Video |
|
warmte transport https://www.youtube.com/watch?v=DpgOe1v25O0&t=21s |
Video |
|
Uitleg Chemische energie levert warmte https://www.youtube.com/watch?v=N_DswvKgMgc |
Video |
|
Uitleg fossiele brandstoffen https://www.youtube.com/watch?v=ay6iQFP-09U&t=3s |
Video |