Het arrangement Water, Deeltjes & Temperatuur is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 04-06-2019 21:28:06
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- 3 Kader
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
Bronnen
| Bron | Type |
|---|---|
|
https://www.youtube.com/watch?v=RBLLanhErVw https://www.youtube.com/watch?v=RBLLanhErVw |
Video |
|
Bekijk video https://ytcropper.com/cropped/RM5cde949c8e091 |
Link |
|
Bekijk de internetsite http://https://wikikids.nl/Celsius |
Link |
|
water en haar fases (1) - leren via filmpje https://www.youtube.com/watch?v=QdA7_RW26Zo |
Video |
|
water en haar fases (2) - leren via filmpje https://www.youtube.com/watch?v=NETdmLe3URY |
Video |
|
Link naar PHET simulatie, klik op 'Toestanden' voor de juiste versie https://phet.colorado.edu/sims/html/states-of-matter/latest/states-of-matter_nl.html |
Link |
|
https://www.youtube.com/watch?v=h4VKIDBlxVA https://www.youtube.com/watch?v=h4VKIDBlxVA |
Video |
|
Het volume berekenen van een regelmatig voorwerp https://www.youtube.com/watch?v=u7EazJLf9V4 |
Video |
|
kennisclip dichtheid berekenen van een onregelmatig voorwerp https://youtu.be/LFaa3qg9HpA |
Video |
|
Informatie over rivieren https://maken.wikiwijs.nl/87259#!page-2511715 |
Link |






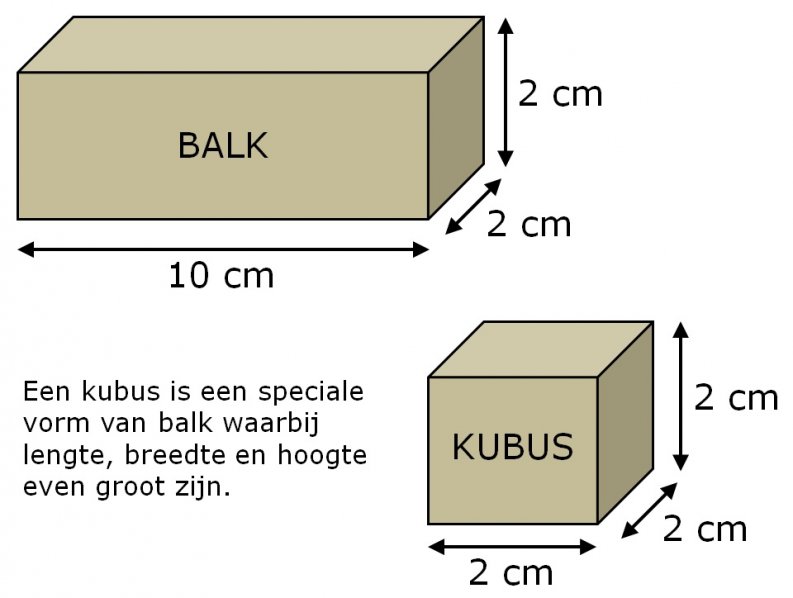
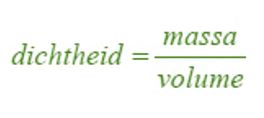 of in symbolen
of in symbolen