Het arrangement Per 2.1 Niv 3 Chemie theorie Titraties is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 01-09-2022 16:58:02
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Titraties en organisch voor leerjaar 2 niveau 3
- Leerniveau
- MBO, Niveau 3: Vakopleiding;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld


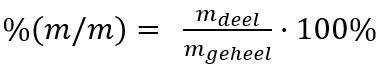



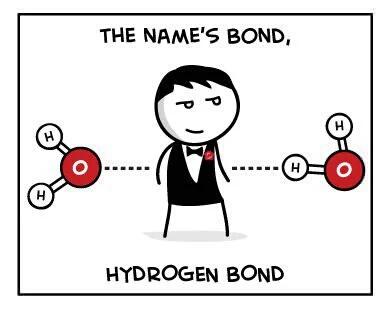
 Ruwweg gezegd kun je chemische stoffen verdelen in twee categorieën: organische- en anorganische verbindingen.
Ruwweg gezegd kun je chemische stoffen verdelen in twee categorieën: organische- en anorganische verbindingen.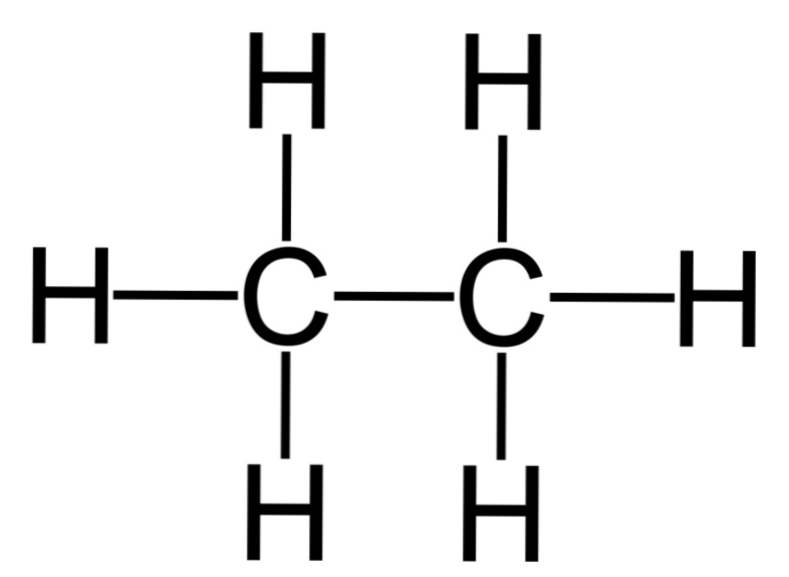
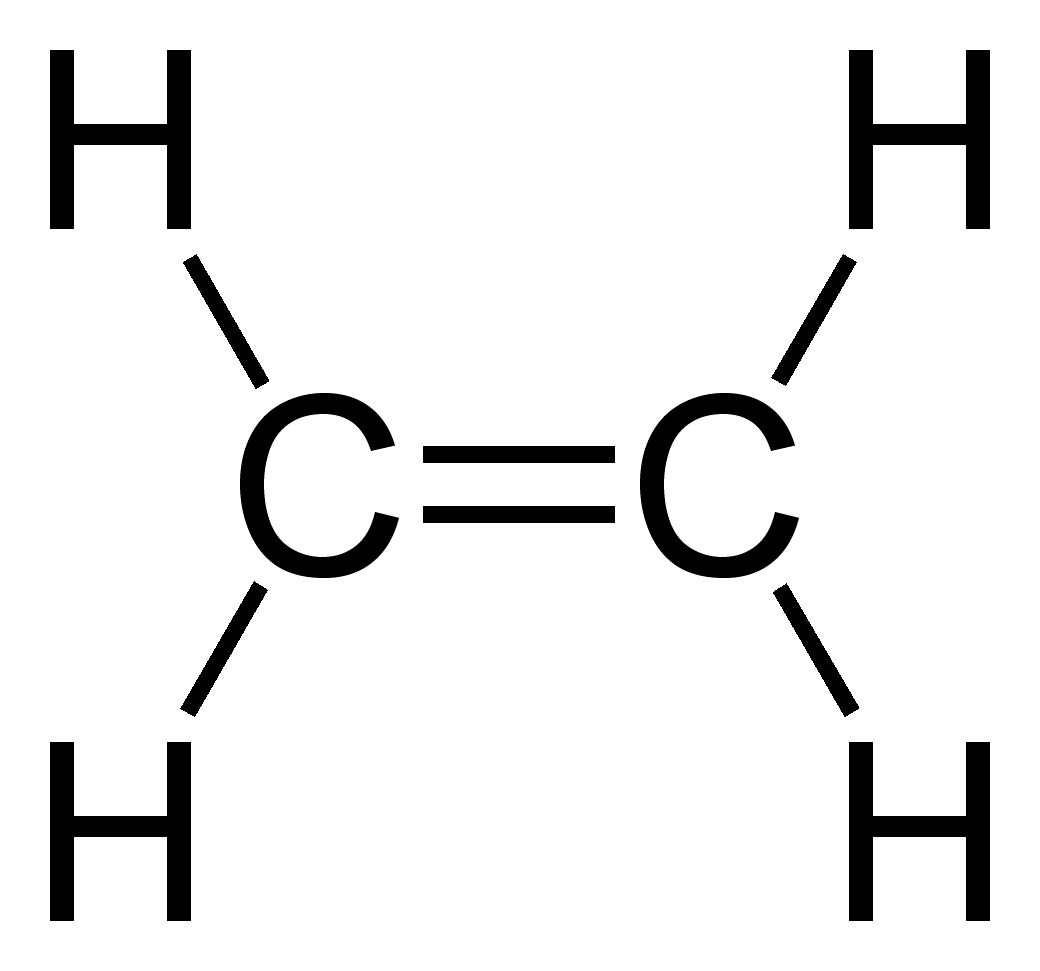
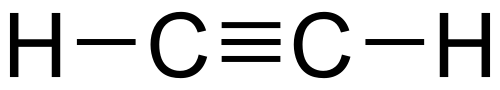
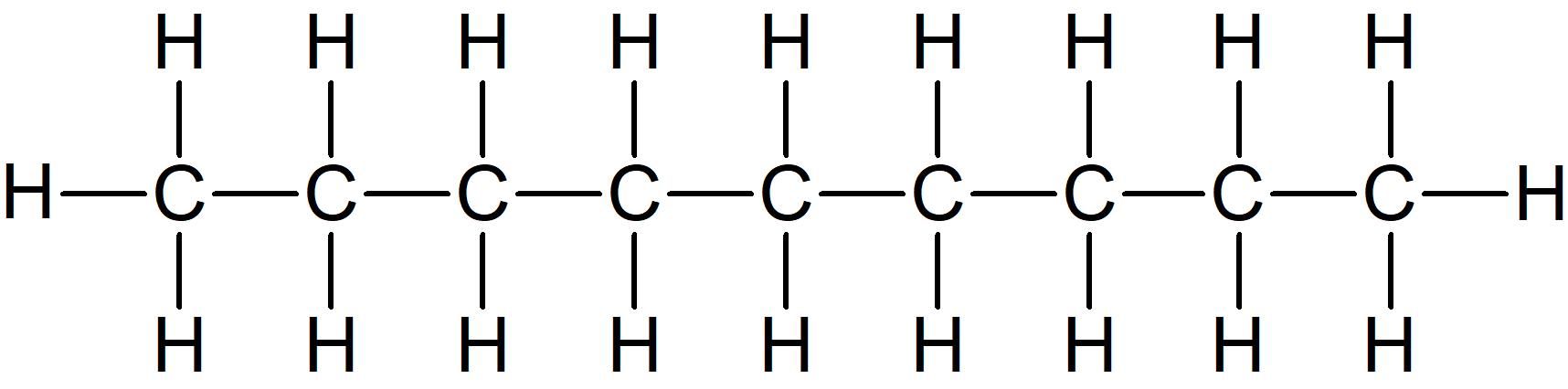
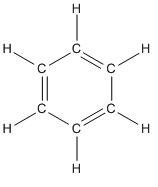
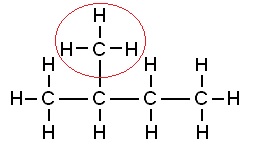
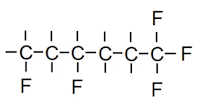

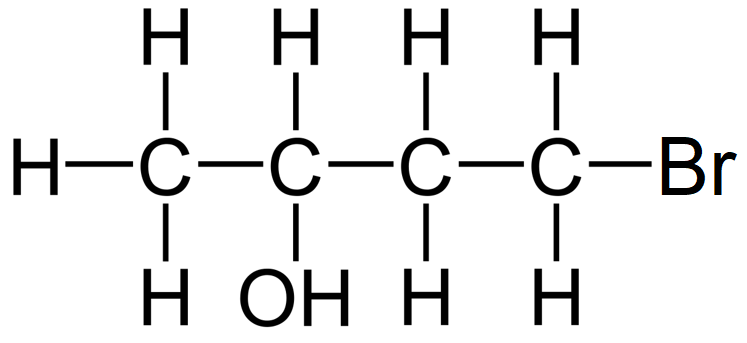 Dit is niet 1-broombutaan-3-ol maar wel 4-broombutaan-2-ol
Dit is niet 1-broombutaan-3-ol maar wel 4-broombutaan-2-ol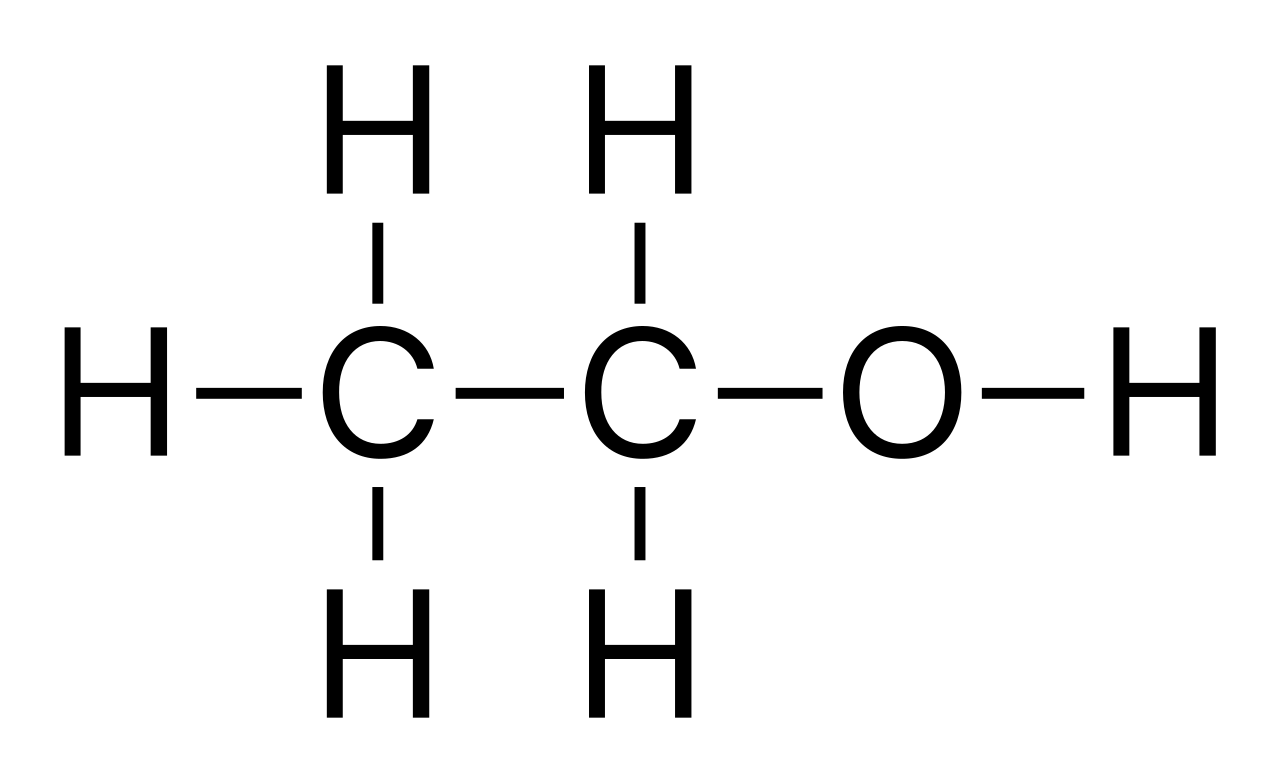


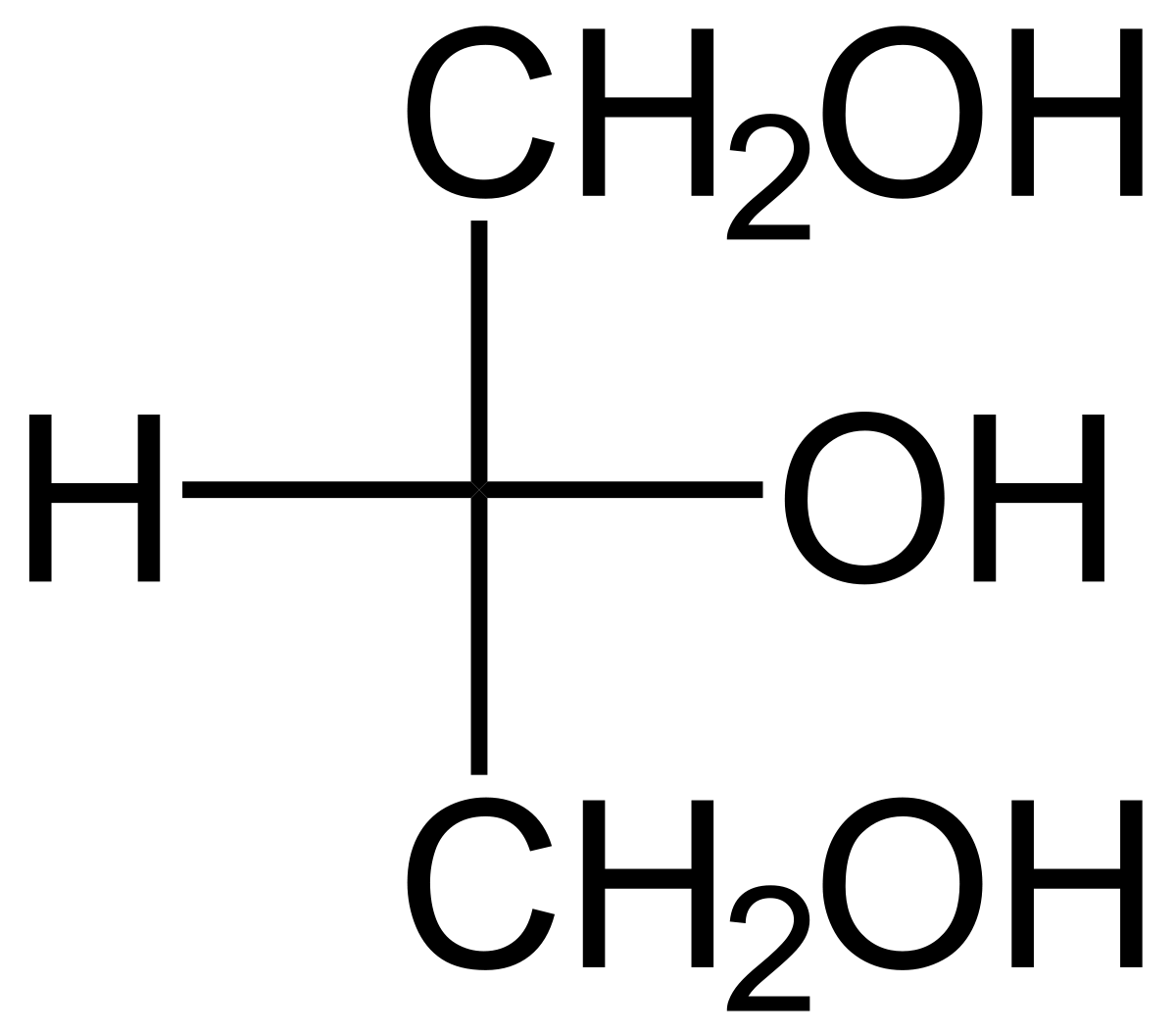 Glycerol
Glycerol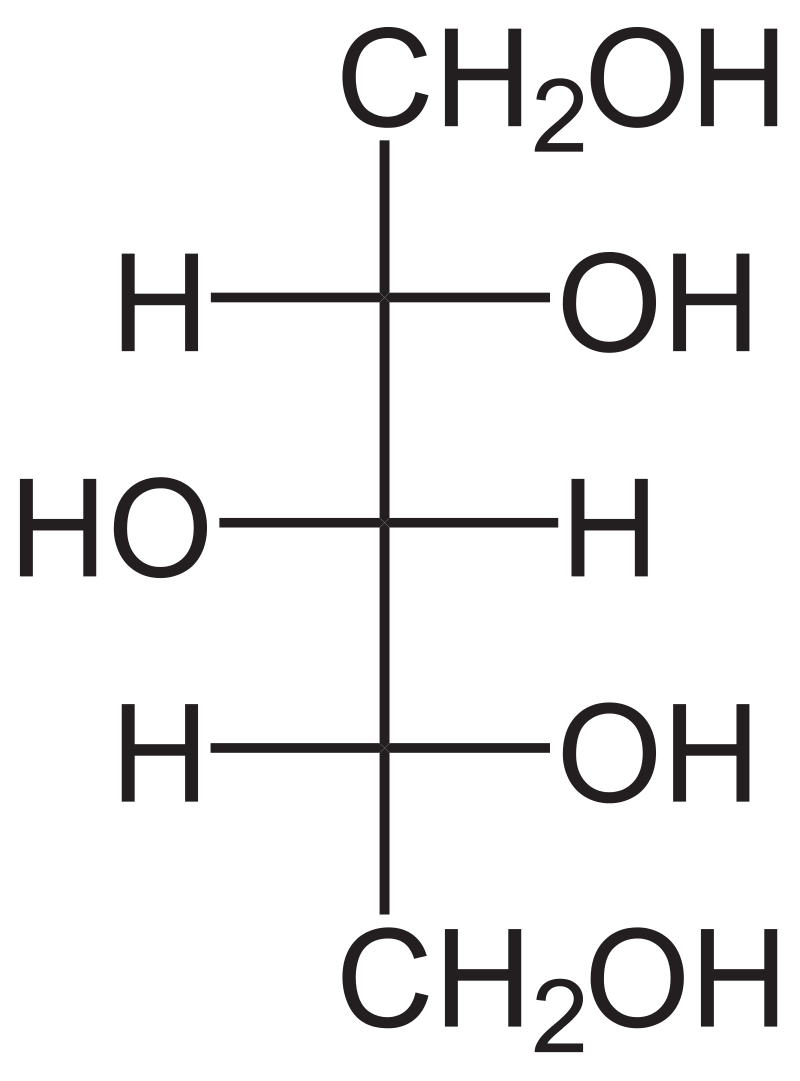
 Aceton
Aceton 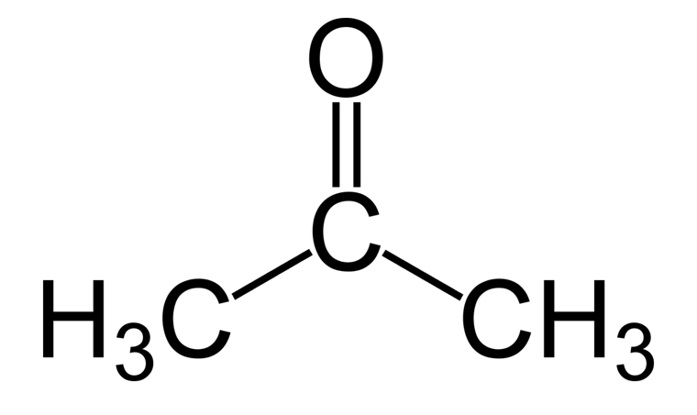
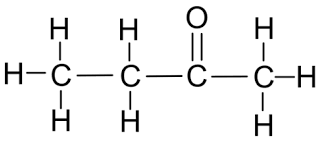
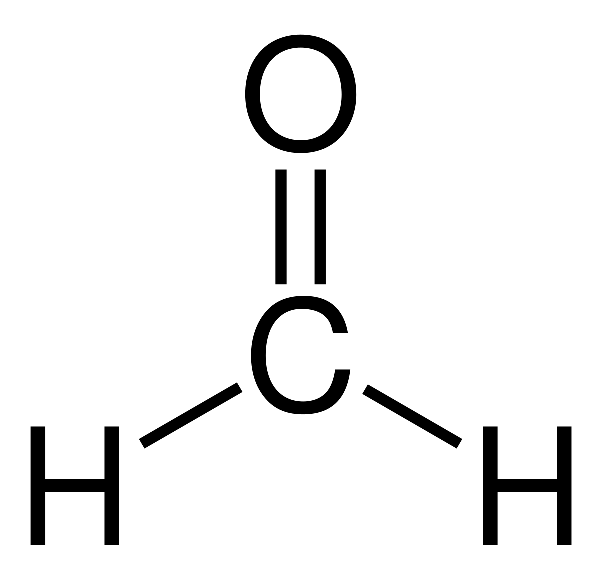 Formaldehyde
Formaldehyde


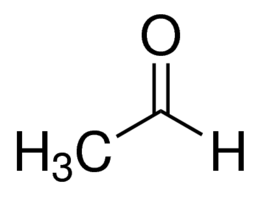 Acetaldehyde
Acetaldehyde 
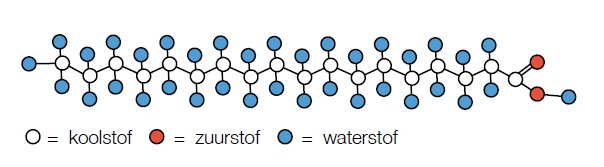

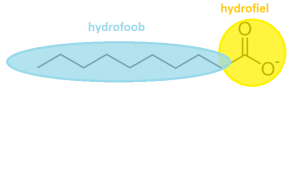 Deze vetzuren gaan met hydrofobe staarten naar elkaar toe zitten. De hydrofiele koppen staan naar buiten want deze willen wel met water (hydro) in aan raking komen. Ze vormen zo een ‘micel’. Deze micellen worden gebruikt in wasmiddelen om vet en vuile deeltjes 'in te kapselen' en zo op te lossen in het water.
Deze vetzuren gaan met hydrofobe staarten naar elkaar toe zitten. De hydrofiele koppen staan naar buiten want deze willen wel met water (hydro) in aan raking komen. Ze vormen zo een ‘micel’. Deze micellen worden gebruikt in wasmiddelen om vet en vuile deeltjes 'in te kapselen' en zo op te lossen in het water. IUPAC is een onafhankelijke organisatie die zich bezighoudt met allerlei standaarden die van belang zijn voor de scheikunde. Dankzij de IUPAC is er wereldwijd een gestandaardiseerde manier voor de systematische naamgeving van organische chemische verbindingen (IUPAC-nomenclatuur*). Ook heeft de IUPAC gezorgd voor een consistente naamgeving van de groepen van het periodiek systeem en onderhouden ze de indeling ervan.
IUPAC is een onafhankelijke organisatie die zich bezighoudt met allerlei standaarden die van belang zijn voor de scheikunde. Dankzij de IUPAC is er wereldwijd een gestandaardiseerde manier voor de systematische naamgeving van organische chemische verbindingen (IUPAC-nomenclatuur*). Ook heeft de IUPAC gezorgd voor een consistente naamgeving van de groepen van het periodiek systeem en onderhouden ze de indeling ervan.