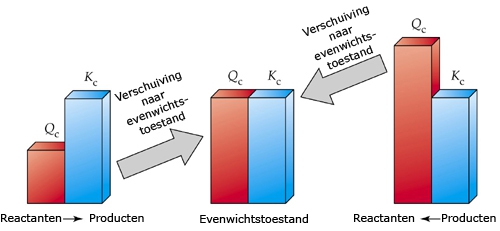
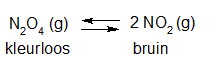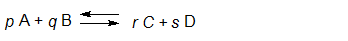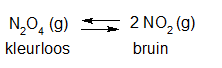Het arrangement Sk11-Reactiesnelheid en Chemisch evenwicht v2 is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 02-09-2017 21:12:31
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 3.0 Nederlands licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Thema over Reactiesnelheid en chemisch evenwicht. Dit thema is overgezet vanuit het vakinhoudelijk deel van een thema over Reactiesnelheid en chemisch evenwicht uit de RdMC kennisbank scheikunde: http://content-e.ou.nl/content-e/pub_RDMC/KBSK_Prototype_09102008_1223556594897/index.htm Behandeld worden: reactiesnelheid, chemisch evenwicht, evenwichtsconstante, regels van Le Chatelier en van't Hoff, homogene en heterogene evenwichten en oplosbaarheidsproduct.
- Leerniveau
- VWO 6; HAVO 5; VWO 4; VWO 5;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Trefwoorden
- chemisch evenwicht, evenwichtsverschuiving, hetergone evenwcihten, ionenproduct, katalysator, le chatelier, oplosbaarheidsproduct, reactiesnelheid, van't hoff
Bronnen
| Bron | Type |
|---|---|
|
Uitleg van het botsende deeltjes model https://youtu.be/X-hHk38qVu8 |
Video |
|
https://youtu.be/hbctH4_MvuE https://youtu.be/hbctH4_MvuE |
Video |
|
Invloed van de concentratie op de reactiesnelheid https://youtu.be/X6sWzkFyjXY |
Video |
|
Invloed van de verdelingsgraad op de reactiesnelheid https://youtu.be/nd-LgmzZIas |
Video |
|
Stofexplosie. https://www.schooltv.nl/beeldbank/embedded.jsp?clip=20031208_23_02stofex |
Video |
|
Animatie van de invloed van temperatuur op de reactiesnelheid. https://www.schooltv.nl/beeldbank/embedded.jsp?clip=20031208_21_02anisne |
Video |
|
Invloed van de temperatuur op de reactiesnelheid. https://youtu.be/Fa_GXl6uaaQ |
Video |
|
Invloed van een katalysator op de reactie snelheid https://youtu.be/9iEwubnaPAw |
Video |
|
Factoren die de reactiesnelheid beïnvloeden. https://youtu.be/e7vKVZL-iZo |
Video |
|
Dynamisch evenwicht. https://youtu.be/2r8hUuUXYo8 |
Video |
|
LIgging van het evenwicht en de evenwichtsvoorwaarde. https://youtu.be/iPOnO4lQkoE |
Video |
|
Verschillende evenwichten. https://youtu.be/wj_vwHn3iXc |
Video |
Gebruikte Wikiwijs Arrangementen
Lutgerink, Jan. (z.d.).
Sk-11 Reactiesnelheid en chemisch evenwicht
https://maken.wikiwijs.nl/45435/Sk_11_Reactiesnelheid_en_chemisch_evenwicht