Het arrangement SK14-Elektrochemie v2 is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 02-09-2017 20:31:43
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 3.0 Nederlands licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
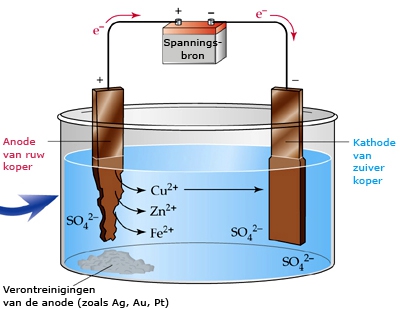
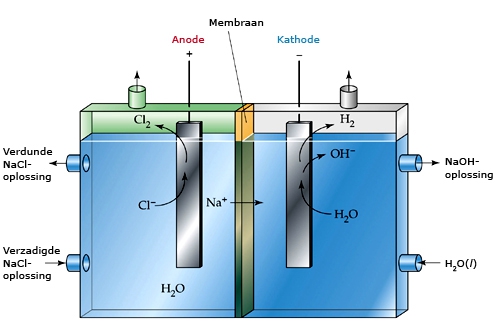
- Thema over Elekrochemie. Dit thema is overgezet vanuit het vakinhoudelijk deel van een thema over Elektrochemie uit de RdMC kennisbank scheikunde: http://content-e.ou.nl/content-e/pub_RDMC/KBSK_Prototype_09102008_1223556594897/index.htm Behandeld worden: Principe en bouw van elektrochemische cellen, corrosie, elektrolyse en de potentiometrische titratie.
- Leerniveau
- VWO 6; VWO 4; VWO 5;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Trefwoorden
- corrosie, eelektrolyse, elektrochemische cel, halfcel, potentiometrische titratie, referentie-elektrode, standaard elektrode, standaard elektrode potentiaal, waterstofelektrode
Bronnen
| Bron | Type |
|---|---|
|
Hoe werkt een batterij of electrochemische cel? https://youtu.be/6H86paPazvY |
Video |
|
De batterij of electrochemische cel in detail bekeken. https://youtu.be/nA-gfbcO_FE |
Video |
|
Uitleg over de elektrolyse. https://youtu.be/Vj1rkla_iU8 |
Video |
|
Vervolg uitleg over de elektrolyse. https://youtu.be/1e8K6oaH-p8 |
Video |
|
Hoe maak je metalen vrij uit verbindingen? https://youtu.be/-TC3IbzgER4 |
Video |