Het arrangement Replicatie en celcyclus is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 21-04-2021 16:43:20
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- De Kennisbanken bevatten de theorie bij de opdrachten.
- Leerinhoud en doelen
- Biologie;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld

 Als cellen zich verdubbelen ontstaan er twee nieuwe cellen. Van de twee nieuwe cellen kan er zich één (of beide) nogmaals verdubbelen. Dit proces kan zich meerdere keren herhalen.
Als cellen zich verdubbelen ontstaan er twee nieuwe cellen. Van de twee nieuwe cellen kan er zich één (of beide) nogmaals verdubbelen. Dit proces kan zich meerdere keren herhalen.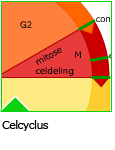



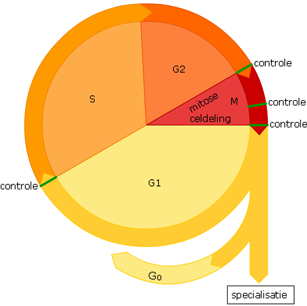 Het proces waarbij cellen zich verdubbelen, de celcyclus, verloopt via een vaste volgorde.
Het proces waarbij cellen zich verdubbelen, de celcyclus, verloopt via een vaste volgorde. Wanneer cellen zich delen moet al het celmateriaal vooraf verdubbeld worden. Dus ook het DNA.
Wanneer cellen zich delen moet al het celmateriaal vooraf verdubbeld worden. Dus ook het DNA.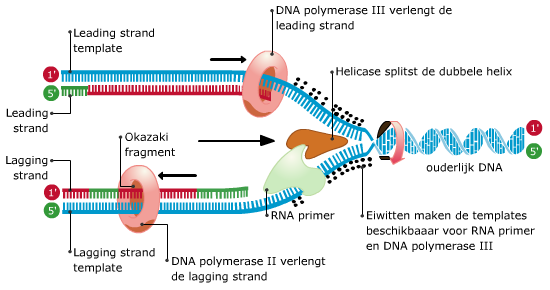

 Tijdens de replicatie ontstaan fouten.
Tijdens de replicatie ontstaan fouten. Een mens bestaat uit ongeveer 1015 cellen. Als een bevruchte eicel zich telkens zou verdubbelen, zouden er ongeveer 50 delingsrondes nodig zijn om dat aantal te bereiken. Maar zo simpel gaat het niet. Er ontstaan wel voortdurend nieuwe cellen, maar lang niet alle cellen doen mee aan deze vermeerdering. En er gaan ook veel cellen dood.
Een mens bestaat uit ongeveer 1015 cellen. Als een bevruchte eicel zich telkens zou verdubbelen, zouden er ongeveer 50 delingsrondes nodig zijn om dat aantal te bereiken. Maar zo simpel gaat het niet. Er ontstaan wel voortdurend nieuwe cellen, maar lang niet alle cellen doen mee aan deze vermeerdering. En er gaan ook veel cellen dood. In het begin van de embryonale ontwikkeling zijn er veel cellen die nog tot allerlei verschillende celtypen kunnen uitgroeien.
In het begin van de embryonale ontwikkeling zijn er veel cellen die nog tot allerlei verschillende celtypen kunnen uitgroeien. Alle cellen van een organisme bevatten hetzelfde DNA. Hoe komt het dat de ene cel zich tot een kraakbeencel ontwikkelt en de andere tot een zaadcel?
Alle cellen van een organisme bevatten hetzelfde DNA. Hoe komt het dat de ene cel zich tot een kraakbeencel ontwikkelt en de andere tot een zaadcel?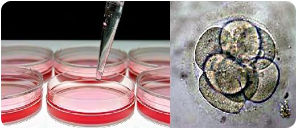
 Volgens de huidige embryowet mogen embryo’s die niet langer voor de eigen zwangerschap worden gebruikt (bijvoorbeeld na IVF), onder bepaalde voorwaarden wel gebruikt worden voor:
Volgens de huidige embryowet mogen embryo’s die niet langer voor de eigen zwangerschap worden gebruikt (bijvoorbeeld na IVF), onder bepaalde voorwaarden wel gebruikt worden voor:
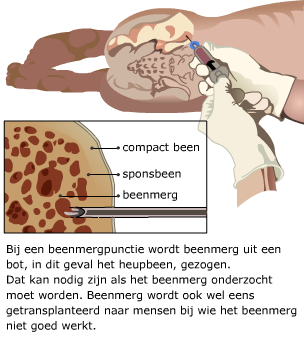
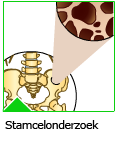
 Beenmerg stamcellen worden bijvoorbeeld ingespoten in het beenmerg bij leukemie patiënten die een chemokuur hebben ondergaan. Door de chemotherapie zijn niet alleen de tumorcellen, maar ook gezonde bloedvormende cellen in het beenmerg afgestorven. Stamcellen van donor-beenmerg of van (tevoren afgenomen) eigen beenmerg kunnen dan gezonde bloedcellen gaan vormen.
Beenmerg stamcellen worden bijvoorbeeld ingespoten in het beenmerg bij leukemie patiënten die een chemokuur hebben ondergaan. Door de chemotherapie zijn niet alleen de tumorcellen, maar ook gezonde bloedvormende cellen in het beenmerg afgestorven. Stamcellen van donor-beenmerg of van (tevoren afgenomen) eigen beenmerg kunnen dan gezonde bloedcellen gaan vormen.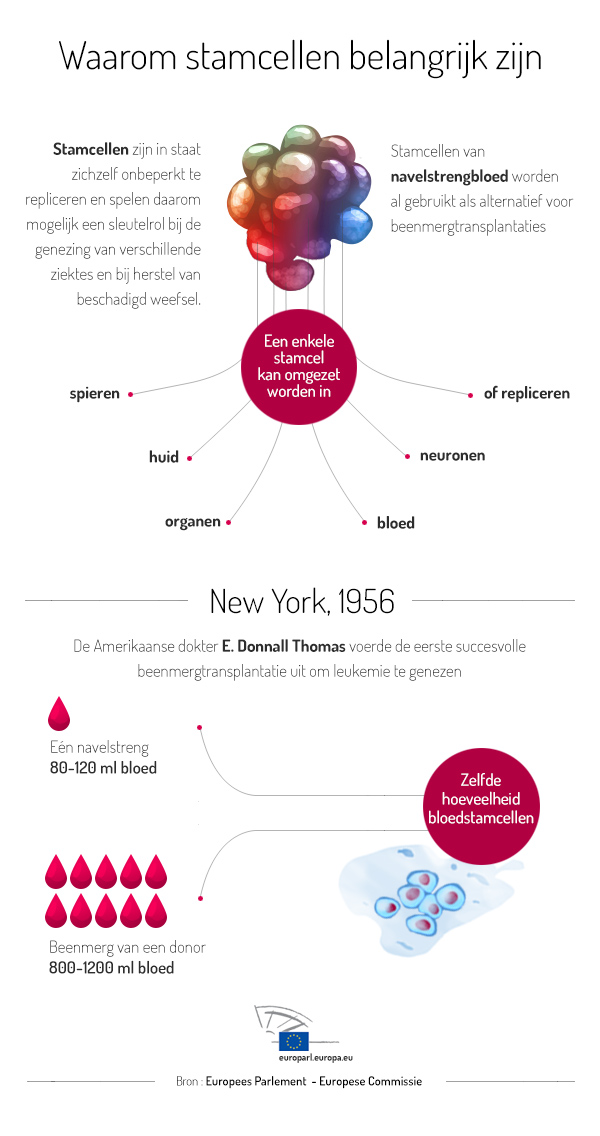
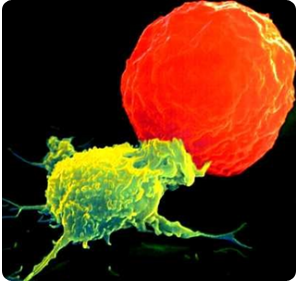
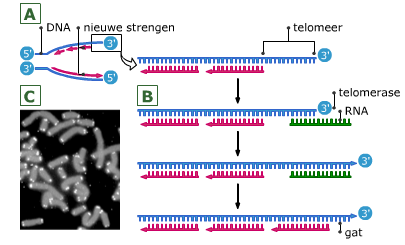
 In de cellen van ons lichaam ontstaat voortdurend DNA-schade.
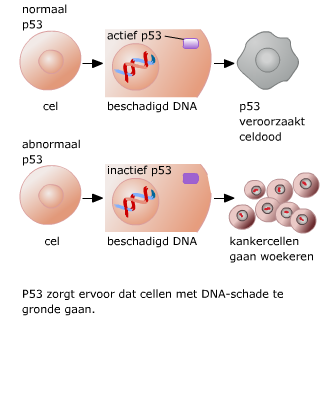
In de cellen van ons lichaam ontstaat voortdurend DNA-schade.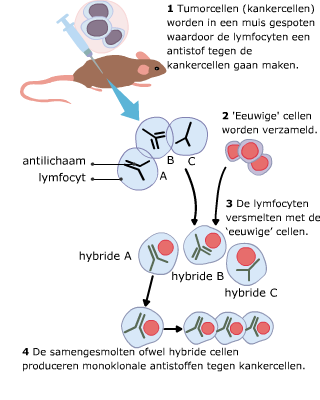 Na een aantal celcycli hebben cellen zoveel fouten verzameld, dat p53 of een soortgelijk mechanisme ervoor zorgt dat de cel ten gronde gaat. Een andere oorzaak voor celdood is dat bij elke deling de chromosomen een stukje korter worden. Dit gebeurt aan de uiteinden van de chromosomen, de telomeren.
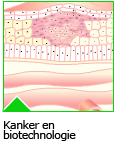
Na een aantal celcycli hebben cellen zoveel fouten verzameld, dat p53 of een soortgelijk mechanisme ervoor zorgt dat de cel ten gronde gaat. Een andere oorzaak voor celdood is dat bij elke deling de chromosomen een stukje korter worden. Dit gebeurt aan de uiteinden van de chromosomen, de telomeren.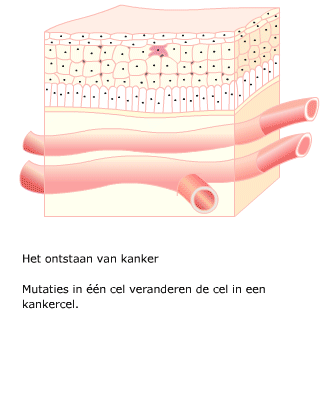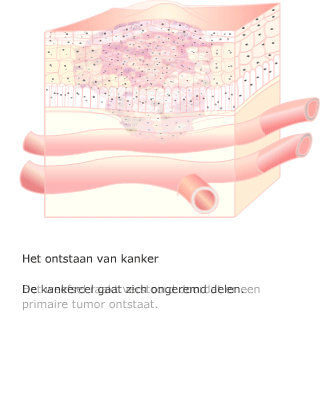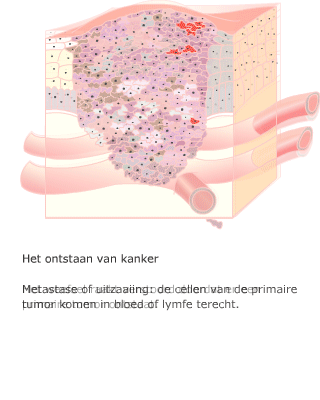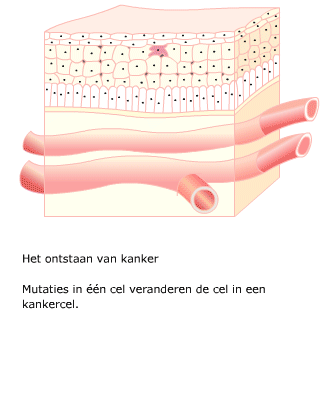 Een cel die meerdere mutaties heeft verzameld, kan zich ontwikkelen tot een kankercel.
Een cel die meerdere mutaties heeft verzameld, kan zich ontwikkelen tot een kankercel. Wanneer een tumor nog niet is uitgezaaid, kan het chirurgisch verwijderen van het gezwel voldoende zijn. Meestal wordt ook bestraling toegepast, om eventueel achtergebleven tumorcellen te doden.
Wanneer een tumor nog niet is uitgezaaid, kan het chirurgisch verwijderen van het gezwel voldoende zijn. Meestal wordt ook bestraling toegepast, om eventueel achtergebleven tumorcellen te doden.