Het arrangement Kringlopen in de natuur is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 17-05-2021 13:27:17
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- De Kennisbanken bevatten de theorie bij de opdrachten.
- Leerinhoud en doelen
- Biologie;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld

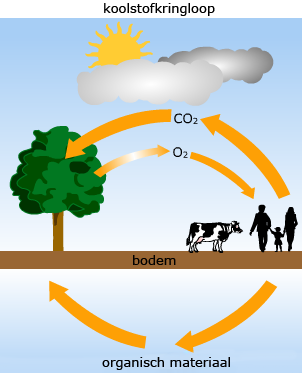 In de natuur is veel vraag naar de elementen koolstof (C), waterstof (H), zuurstof (O) en stikstof (N). Organismen gebruiken deze voor het maken van allerlei organische moleculen. Ze hebben daarvoor ook nog allerlei andere elementen nodig, meestal in kleinere hoeveelheden. Het gaat dan bijvoorbeeld om Ca, Mg, P, K,Cl, S, I, Cu, Zn. Aan de basis van de synthese van organische moleculen staan producenten. Vervolgens doorlopen de organische stoffen de diverse consumenten van de voedselketen. Uiteindelijk maken reducenten van het organisch materiaal dat door consumenten uitscheiden wordt weer anorganische moleculen. Zo is er sprake van een kringloop.
In de natuur is veel vraag naar de elementen koolstof (C), waterstof (H), zuurstof (O) en stikstof (N). Organismen gebruiken deze voor het maken van allerlei organische moleculen. Ze hebben daarvoor ook nog allerlei andere elementen nodig, meestal in kleinere hoeveelheden. Het gaat dan bijvoorbeeld om Ca, Mg, P, K,Cl, S, I, Cu, Zn. Aan de basis van de synthese van organische moleculen staan producenten. Vervolgens doorlopen de organische stoffen de diverse consumenten van de voedselketen. Uiteindelijk maken reducenten van het organisch materiaal dat door consumenten uitscheiden wordt weer anorganische moleculen. Zo is er sprake van een kringloop.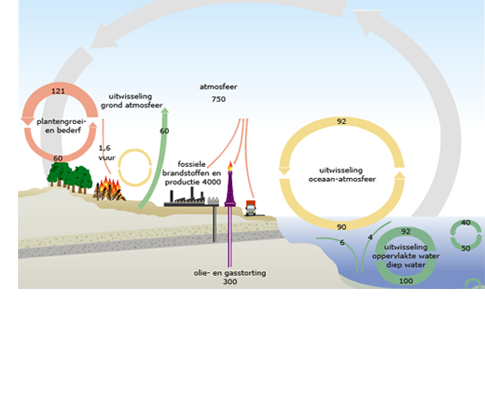 In de natuur gaat organische stof over van het ene organisme in het andere, totdat reducenten de materie weer afbreken tot anorganische stoffen. Zo'n cyclische omzetting van stoffen door organismen heet een kringloop.
In de natuur gaat organische stof over van het ene organisme in het andere, totdat reducenten de materie weer afbreken tot anorganische stoffen. Zo'n cyclische omzetting van stoffen door organismen heet een kringloop.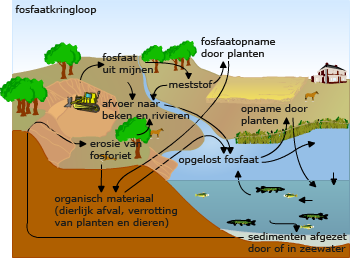 Kringloop van mineralen
Kringloop van mineralen Bijna elk materiaal in de natuur wordt uiteindelijk weer door reducenten gereduceerd tot anorganische stoffen. Bij sommige stoffen gaat dat langzamer dan bij andere stoffen. Hout blijft bijvoorbeeld vrij lang liggen in een bos. Dat komt doordat er niet zoveel bacteriesoorten of schimmelsoorten zijn die hout (lignine) kunnen afbreken. Hout is daarom minder biologisch afbreekbaar dan het vlees van een dood dier, dat door meerder soorten bacteriën kan worden afgebroken.
Bijna elk materiaal in de natuur wordt uiteindelijk weer door reducenten gereduceerd tot anorganische stoffen. Bij sommige stoffen gaat dat langzamer dan bij andere stoffen. Hout blijft bijvoorbeeld vrij lang liggen in een bos. Dat komt doordat er niet zoveel bacteriesoorten of schimmelsoorten zijn die hout (lignine) kunnen afbreken. Hout is daarom minder biologisch afbreekbaar dan het vlees van een dood dier, dat door meerder soorten bacteriën kan worden afgebroken. Het gebruik van niet afbreekbare producten zoals plastics onttrekt stoffen aan de kringloop. In de natuur worden soms ook stoffen voor langere tijd aan de kringloop onttrokken. Maar materie verdwijnt nooit. Uiteindelijk komen alle elementen weer terug in de kringloop.
Het gebruik van niet afbreekbare producten zoals plastics onttrekt stoffen aan de kringloop. In de natuur worden soms ook stoffen voor langere tijd aan de kringloop onttrokken. Maar materie verdwijnt nooit. Uiteindelijk komen alle elementen weer terug in de kringloop.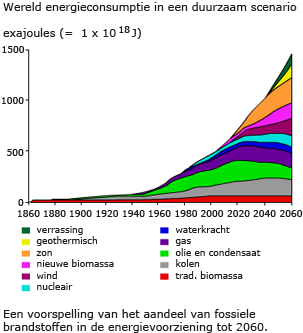

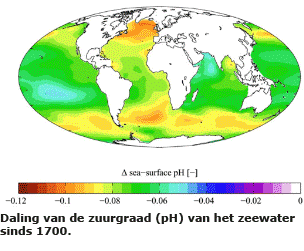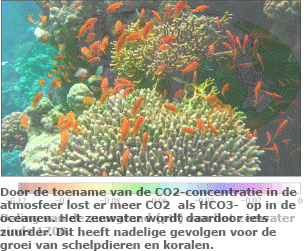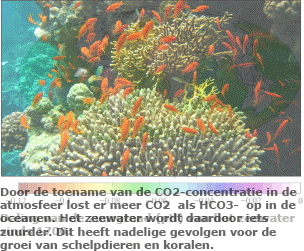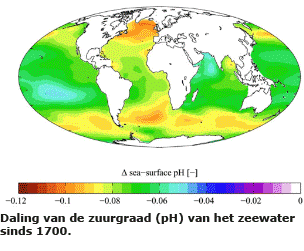 De totale hoeveelheid koolstof op aarde is dus verdeeld over verschillende reservoirs van anorganische en organische stoffen. Tussen al deze reservoirs zijn voortdurend uitwisselingen. Ze houden elkaar in evenwicht. Maar het evenwicht is sinds het begin van de industriële revolutie verstoord, doordat er meer fossiele brandstoffen worden verbrand dan er gevormd worden.
De totale hoeveelheid koolstof op aarde is dus verdeeld over verschillende reservoirs van anorganische en organische stoffen. Tussen al deze reservoirs zijn voortdurend uitwisselingen. Ze houden elkaar in evenwicht. Maar het evenwicht is sinds het begin van de industriële revolutie verstoord, doordat er meer fossiele brandstoffen worden verbrand dan er gevormd worden.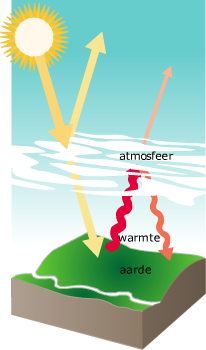 Het gevolg van de toegenomen hoeveelheid CO2 is groot. Dat komt doordat CO2 een broeikasgas is. Broeikasgassen houden de warmtestraling die de aarde uitzend gedeeltelijk tegen. Dat is gunstig want ze voorkomen dat de aarde ’s nachts te sterk afkoelt.
Het gevolg van de toegenomen hoeveelheid CO2 is groot. Dat komt doordat CO2 een broeikasgas is. Broeikasgassen houden de warmtestraling die de aarde uitzend gedeeltelijk tegen. Dat is gunstig want ze voorkomen dat de aarde ’s nachts te sterk afkoelt.
 Een planteneter zet de stikstofhoudende stoffen in zijn voedsel (zoals eiwitten) om in stikstofhoudende stoffen die voor hem nuttig zijn. In sommige gevallen breekt hij ze af voor zijn energievoorziening. Bij die afbraak komen stoffen als ureum (NH2) 2CO en urinezuur vrij (C5H4N4O3). Deze stoffen worden uitgeplast.
Een planteneter zet de stikstofhoudende stoffen in zijn voedsel (zoals eiwitten) om in stikstofhoudende stoffen die voor hem nuttig zijn. In sommige gevallen breekt hij ze af voor zijn energievoorziening. Bij die afbraak komen stoffen als ureum (NH2) 2CO en urinezuur vrij (C5H4N4O3). Deze stoffen worden uitgeplast. Stikstofverbindingen worden in lucht, water en bodem voortdurend in andere stikstofverbindingen omgezet. Als je alleen naar de stikstof kijkt, kun je spreken van een stikstofkringloop, stikstof wordt steeds weer gerecycled. De stikstof die eerst nog in de lucht aanwezig was, kan later behoren tot het DNA van een mens en vervolgens weer worden afgebroken tot urinezuur. In het riool benutten urobacteriën de energie die nog in het urinezuur aanwezig is en maken er ammoniak van. Ammoniak kan vervolgens weer door andere bacteriën worden omgezet in bijvoorbeeld ammonium.
Stikstofverbindingen worden in lucht, water en bodem voortdurend in andere stikstofverbindingen omgezet. Als je alleen naar de stikstof kijkt, kun je spreken van een stikstofkringloop, stikstof wordt steeds weer gerecycled. De stikstof die eerst nog in de lucht aanwezig was, kan later behoren tot het DNA van een mens en vervolgens weer worden afgebroken tot urinezuur. In het riool benutten urobacteriën de energie die nog in het urinezuur aanwezig is en maken er ammoniak van. Ammoniak kan vervolgens weer door andere bacteriën worden omgezet in bijvoorbeeld ammonium.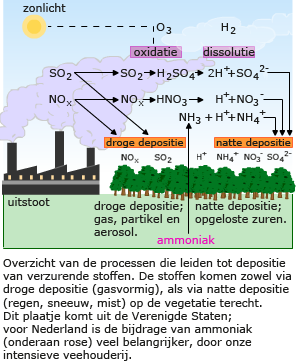 Het evenwicht in de stikstofkringloop kan op verschillende manieren verstoord raken.
Het evenwicht in de stikstofkringloop kan op verschillende manieren verstoord raken. De bodem bevat buffers, zoals kalk en humus, die de zuren tot op zekere hoogte kunnen neutraliseren. Aan deze buffers zijn allerlei stoffen gebonden. Als de buffercapaciteit wordt overschreden, daalt de pH in de bodem. De verbinding tussen buffers en voedingsstoffen wordt dan verbroken en de voedingsstoffen spoelen weg met het grondwater. Door de verzuring van de bodem kunnen giftige metalen zoals aluminium oplossen waardoor de plantenwortels worden aantast. Vooral vegetaties die voorkomen op weinig gebufferde bodems, zoals zure zandgronden, zijn heel gevoelig voor verzuring.
De bodem bevat buffers, zoals kalk en humus, die de zuren tot op zekere hoogte kunnen neutraliseren. Aan deze buffers zijn allerlei stoffen gebonden. Als de buffercapaciteit wordt overschreden, daalt de pH in de bodem. De verbinding tussen buffers en voedingsstoffen wordt dan verbroken en de voedingsstoffen spoelen weg met het grondwater. Door de verzuring van de bodem kunnen giftige metalen zoals aluminium oplossen waardoor de plantenwortels worden aantast. Vooral vegetaties die voorkomen op weinig gebufferde bodems, zoals zure zandgronden, zijn heel gevoelig voor verzuring.