Het arrangement Omstandigheden is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 17-05-2021 09:06:01
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- De Kennisbanken bevatten de theorie bij de opdrachten.
- Leerinhoud en doelen
- Biologie;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld

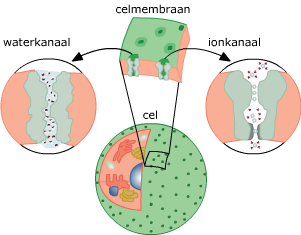 Om zichzelf in stand te kunnen houden moeten cellen een groot aantal chemische reacties uitvoeren.
Om zichzelf in stand te kunnen houden moeten cellen een groot aantal chemische reacties uitvoeren.

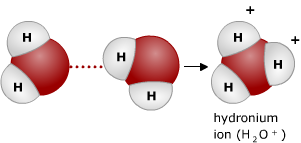 Water moleculen kunnen uit elkaar vallen in H3O+ en OH-. (Dit komt doordat een waterstof ion van het ene watermolecuul aan het ander wordt overgedragen. Er blijft dan een OH- ion achter).
Water moleculen kunnen uit elkaar vallen in H3O+ en OH-. (Dit komt doordat een waterstof ion van het ene watermolecuul aan het ander wordt overgedragen. Er blijft dan een OH- ion achter).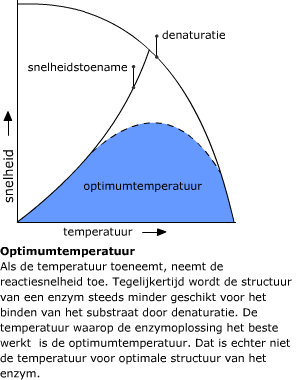 Met name eiwitten zijn erg gevoelig voor veranderingen in de pH. Dit komt doordat de zijketens van de aminozuren waaruit een eiwit is opgebouwd afhankelijk van de pH geprotoneerd of gedeprotoneerd zijn.
Met name eiwitten zijn erg gevoelig voor veranderingen in de pH. Dit komt doordat de zijketens van de aminozuren waaruit een eiwit is opgebouwd afhankelijk van de pH geprotoneerd of gedeprotoneerd zijn.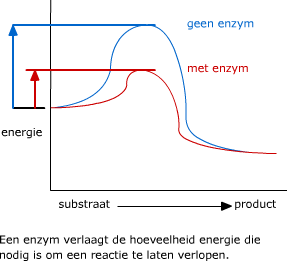 Om een reactie te laten verlopen, is het in de eerste plaats nodig dat de te reageren moleculen elkaar tegenkomen. Als dat gebeurt, hebben ze bovendien energie nodig om met elkaar te reageren. Is er niet voldoende energie, dan vindt er geen reactie plaats. De benodigde energie noemen we activeringsenergie. Hoe groot deze is, hangt af van de reactie.
Om een reactie te laten verlopen, is het in de eerste plaats nodig dat de te reageren moleculen elkaar tegenkomen. Als dat gebeurt, hebben ze bovendien energie nodig om met elkaar te reageren. Is er niet voldoende energie, dan vindt er geen reactie plaats. De benodigde energie noemen we activeringsenergie. Hoe groot deze is, hangt af van de reactie. In het actieve centrum komen vaak speciale hulpstoffen voor die een rol spelen bij de scheikundige reactie.
In het actieve centrum komen vaak speciale hulpstoffen voor die een rol spelen bij de scheikundige reactie.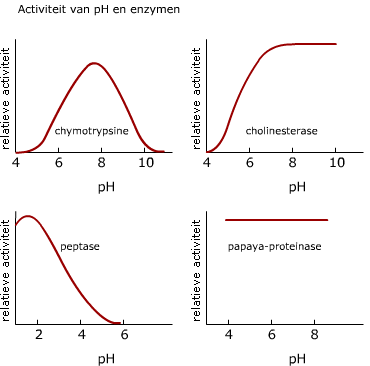 Elk enzym heeft een bepaalde pH waarbij zijn structuur optimaal is. Voor veel enzymen ligt dat pH-optimum bij pH 7, maar het enzym peptase in je maag b.v. werkt het best bij een veel lagere pH.
Elk enzym heeft een bepaalde pH waarbij zijn structuur optimaal is. Voor veel enzymen ligt dat pH-optimum bij pH 7, maar het enzym peptase in je maag b.v. werkt het best bij een veel lagere pH.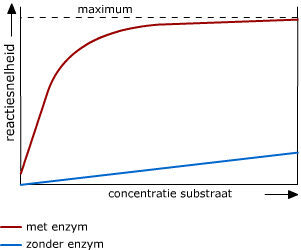 In de figuur zie je het verschil tussen een reactie die met een enzym en een reactie die zonder enzym verloopt.
In de figuur zie je het verschil tussen een reactie die met een enzym en een reactie die zonder enzym verloopt. Enzymen kunnen door bepaalde stoffen in hun werking geremd worden.
Enzymen kunnen door bepaalde stoffen in hun werking geremd worden.