Het arrangement Elementen en verbinding is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 06-05-2021 10:08:05
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- De Kennisbanken bevatten de theorie bij de opdrachten.
- Leerinhoud en doelen
- Biologie;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld

 Organismen bestaan uit stoffen, uit materie. Bij het vak scheikunde heb je natuurlijk al geleerd dat levende en dode materie uit atomen bestaat. Om de reacties in cellen te kunnen begrijpen, moet je iets weten van atomen en van de verbindingen daartussen.
Organismen bestaan uit stoffen, uit materie. Bij het vak scheikunde heb je natuurlijk al geleerd dat levende en dode materie uit atomen bestaat. Om de reacties in cellen te kunnen begrijpen, moet je iets weten van atomen en van de verbindingen daartussen.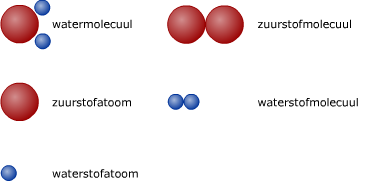 Sommige stoffen bestaan uit atomen van één enkele soort, bijvoorbeeld zuurstof O2. Stoffen die bestaan uit meerdere atoomsoorten noemt men samengestelde stoffen. Atomen kunnen hun elektronen met elkaar delen en dit is de basis voor de chemische binding.
Sommige stoffen bestaan uit atomen van één enkele soort, bijvoorbeeld zuurstof O2. Stoffen die bestaan uit meerdere atoomsoorten noemt men samengestelde stoffen. Atomen kunnen hun elektronen met elkaar delen en dit is de basis voor de chemische binding.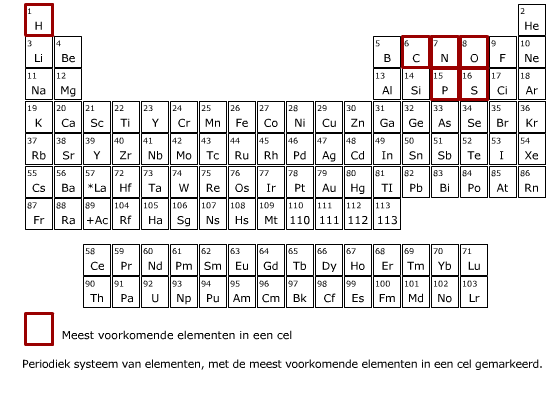 Verbindingen
Verbindingen Elk atoom heeft zijn eigen atoomnummer.
Elk atoom heeft zijn eigen atoomnummer.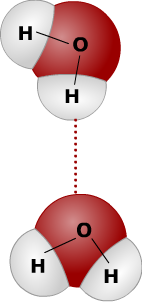 Twee of meer atomen die aan elkaar verbonden zijn, vormen een molecuul.
Twee of meer atomen die aan elkaar verbonden zijn, vormen een molecuul.
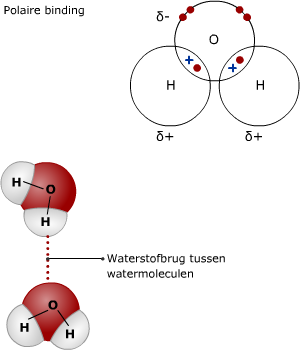
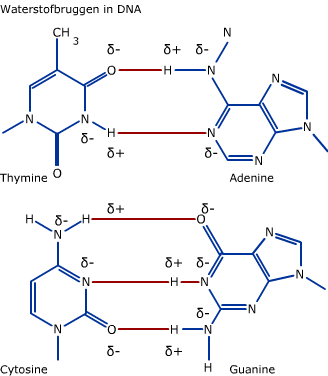

 Cellen bestaan voor het grootste gedeelte uit water.
Cellen bestaan voor het grootste gedeelte uit water. Water is een anorganische stof. Andere belangrijke anorganische stoffen zijn koolstofdioxide (CO2) en zuurstof (O2). Ook zouten zijn anorganische stoffen.
Water is een anorganische stof. Andere belangrijke anorganische stoffen zijn koolstofdioxide (CO2) en zuurstof (O2). Ook zouten zijn anorganische stoffen.
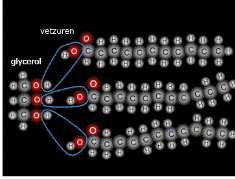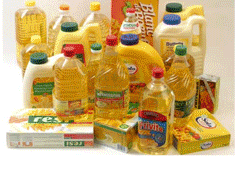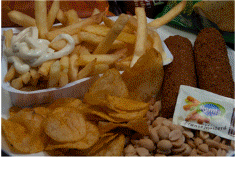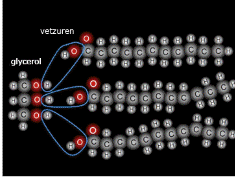
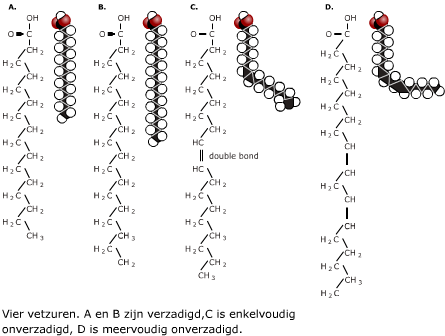
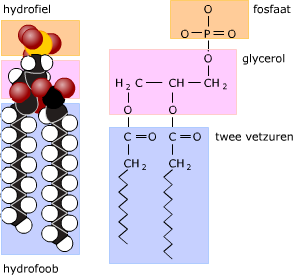
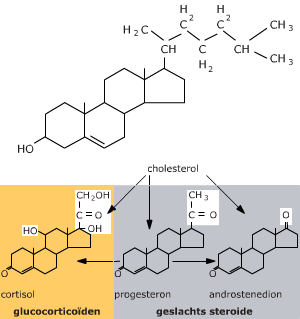
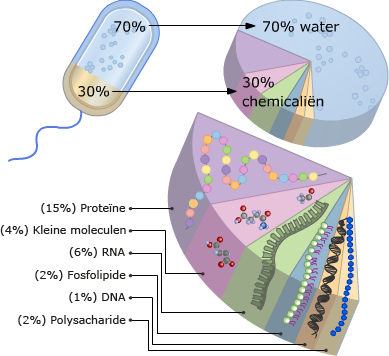
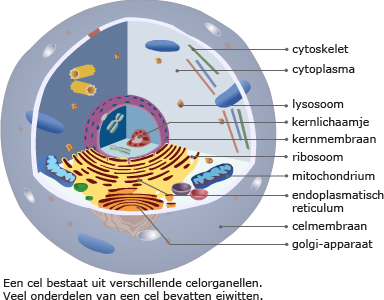
 Meer dan 50% van de droge stof van een cel bestaat uit eiwitten. De eiwitten in een cel hebben ieder een eigen functie. Eiwitten bestaan uit de elementen C, H, O en N (stikstof) en soms ook nog S (zwavel).
Meer dan 50% van de droge stof van een cel bestaat uit eiwitten. De eiwitten in een cel hebben ieder een eigen functie. Eiwitten bestaan uit de elementen C, H, O en N (stikstof) en soms ook nog S (zwavel).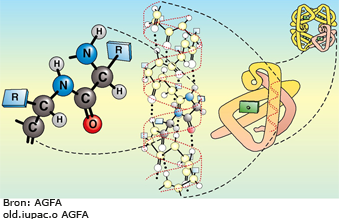
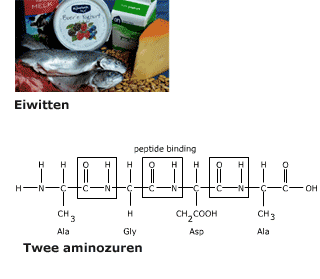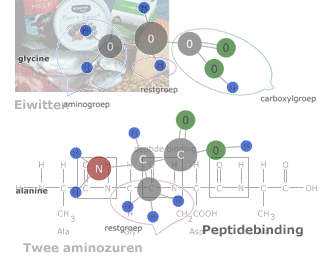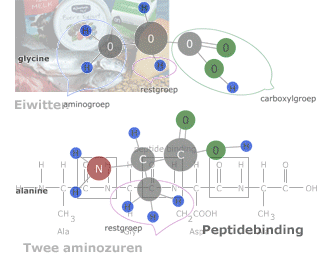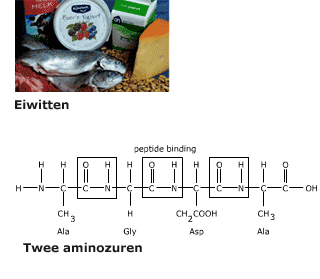
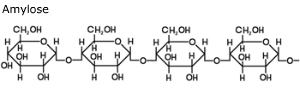
 De volgorde waarin de aminozuren door peptide-bindingen aan elkaar zitten in een eiwit noem je de primaire structuur.
De volgorde waarin de aminozuren door peptide-bindingen aan elkaar zitten in een eiwit noem je de primaire structuur.
 De eiwitten in een cel hebben ieder een eigen functie.
De eiwitten in een cel hebben ieder een eigen functie.

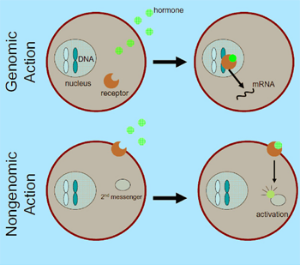

 De duizenden chemische reacties in een cel worden versneld of vertraagd door een grote groep eiwitten, de enzymen. Voor hun werking is de tertiaire en quartaire structuur heel belangrijk. De namen van enzymen zijn vaak afgeleid van de reactie die ze beïnvloeden.
De duizenden chemische reacties in een cel worden versneld of vertraagd door een grote groep eiwitten, de enzymen. Voor hun werking is de tertiaire en quartaire structuur heel belangrijk. De namen van enzymen zijn vaak afgeleid van de reactie die ze beïnvloeden.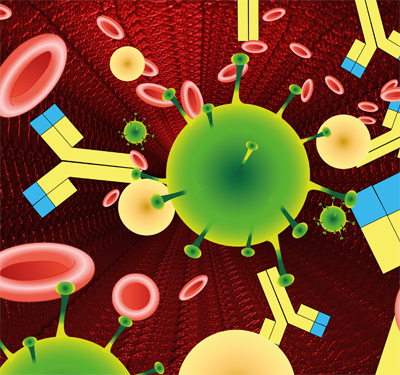 In het bloed komen antistoffen voor die het lichaam ondersteunen bij het bestrijden van lichaamsvreemde stoffen die zijn binnengedrongen. Deze antistoffen (geel-blauwe moleculen in de afbeelding) zijn eiwitten. Ze kunnen binden met bijvoorbeeld de eiwitten op de membraan van een binnengedrongen ziekteverwekker (groen). Die ziekteverwekkers klonteren dan samen en kunnen door weer andere cellen worden herkend en vernietigd. Eiwitten, los in het bloed en gebonden aan membranen, spelen dus een grote rol bij de herkenning van lichaamseigen en lichaamsvreemd.
In het bloed komen antistoffen voor die het lichaam ondersteunen bij het bestrijden van lichaamsvreemde stoffen die zijn binnengedrongen. Deze antistoffen (geel-blauwe moleculen in de afbeelding) zijn eiwitten. Ze kunnen binden met bijvoorbeeld de eiwitten op de membraan van een binnengedrongen ziekteverwekker (groen). Die ziekteverwekkers klonteren dan samen en kunnen door weer andere cellen worden herkend en vernietigd. Eiwitten, los in het bloed en gebonden aan membranen, spelen dus een grote rol bij de herkenning van lichaamseigen en lichaamsvreemd.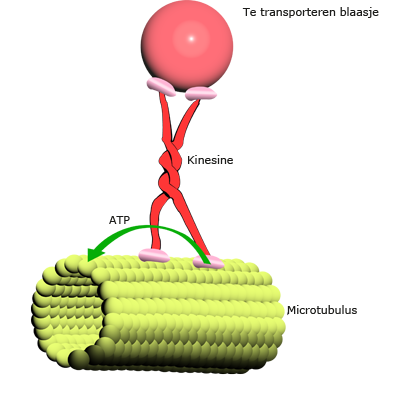 Een motoreiwit is een eiwit dat gespecialiseerd is in het transporteren van onderdelen van de cel binnen de cel. Motoreiwitten bewegen zich over de filamenten van het cytoskelet. Ze zorgen zo o.a. voor het transport van organellen, voor het samentrekken van spieren en voor het transport van chromosomen tijdens de mitose. Ze worden aangedreven door ATP.
Een motoreiwit is een eiwit dat gespecialiseerd is in het transporteren van onderdelen van de cel binnen de cel. Motoreiwitten bewegen zich over de filamenten van het cytoskelet. Ze zorgen zo o.a. voor het transport van organellen, voor het samentrekken van spieren en voor het transport van chromosomen tijdens de mitose. Ze worden aangedreven door ATP.