Het arrangement Transport is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 05-05-2021 14:13:10
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- De Kennisbanken bevatten de theorie bij de opdrachten.
- Leerinhoud en doelen
- Biologie;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld

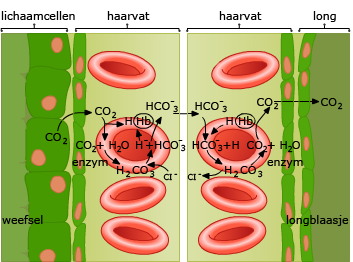
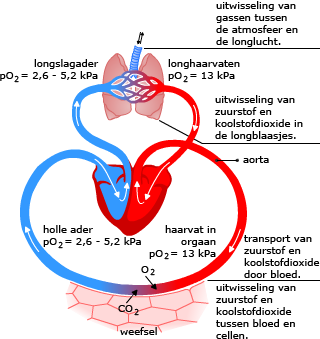 Voor een meercellige is het van belang om de gassen die bij de gaswisseling een rol spelen zo snel mogelijk naar en van de cellen te transporteren.
Voor een meercellige is het van belang om de gassen die bij de gaswisseling een rol spelen zo snel mogelijk naar en van de cellen te transporteren.
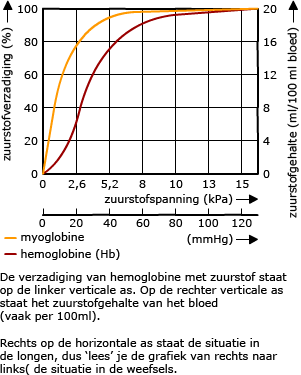
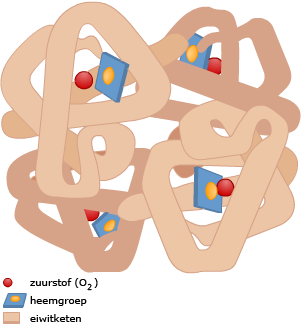 In rode bloedcellen zit hemoglobine.
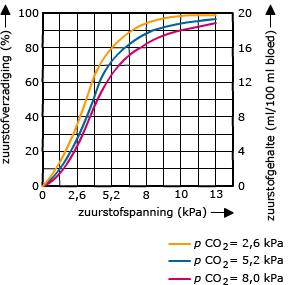
In rode bloedcellen zit hemoglobine. De manier waarop koolstofdioxide door het bloed vervoerd wordt is anders dan bij zuurstof.
De manier waarop koolstofdioxide door het bloed vervoerd wordt is anders dan bij zuurstof.