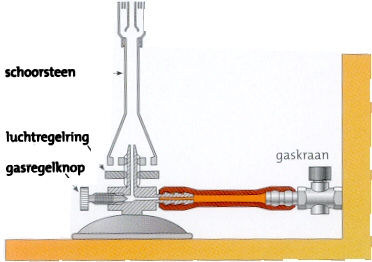
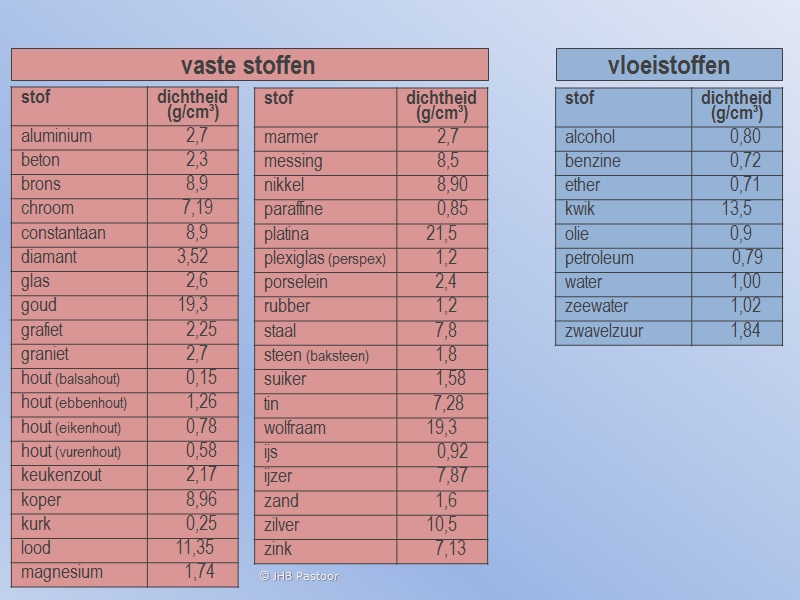
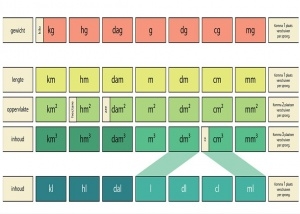
Het arrangement Mengen en Scheiden is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 02-11-2022 09:48:59
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 3.0 Nederlands licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Wikiwijs arrangement voor H3
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
Bronnen
| Bron | Type |
|---|---|
|
filmpje over veiligheid in het lab https://vimeo.com/214167690 |
Video |
|
https://www.youtube.com/watch?v=FnFeWIicRh0 https://www.youtube.com/watch?v=FnFeWIicRh0 |
Link |
|
stofeigenschappen https://www.youtube.com/watch?v=cRuNky4bZLc |
Link |
|
stofeigenschappen en gevarensymbolen https://www.youtube.com/watch?v=U0cr371JmqM |
Link |
|
filmpje fasen en faseovergangen https://www.youtube.com/watch?v=9dDkICALR9o |
Link |
|
http://www.betavakken.nl/natuurkunde/Kennisbank/Scheikunde/Dichtheid/Massa%20en%20dichtheid.pdf http://www.betavakken.nl/natuurkunde/Kennisbank/Scheikunde/Dichtheid/Massa%20en%20dichtheid.pdf |
Link |
|
https://www.nemokennislink.nl/publicaties/wat-zijn-moleculen/ https://www.nemokennislink.nl/publicaties/wat-zijn-moleculen/ |
Link |
|
filmpje met uitleg oplossing, suspensie en emulsie https://www.youtube.com/watch?v=3I4LSohPbKw |
Link |
|
filmpje mengsel en zuivere stof https://www.youtube.com/embed/Jz9F-ahMqIw |
Link |
|
https://maken.wikiwijs.nl/userfiles/5b09e192be5c8f157714b51ca3715bee08ea0149.pdf https://maken.wikiwijs.nl/userfiles/5b09e192be5c8f157714b51ca3715bee08ea0149.pdf |
Link |
|
https://www.youtube.com/watch?v=wbbggwTBz-E https://www.youtube.com/watch?v=wbbggwTBz-E |
Link |