Het arrangement Atoommodellen is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 27-01-2017 13:41:31
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 3.0 Nederlands licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
Bronnen
| Bron | Type |
|---|---|
|
https://youtu.be/koiWhu-cVWE https://youtu.be/koiWhu-cVWE |
Video |


 John Dalton Antoommoddulle
John Dalton Antoommoddulle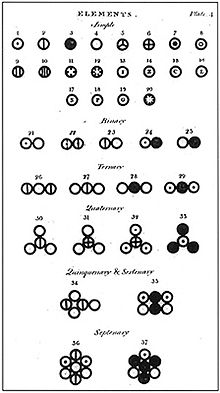
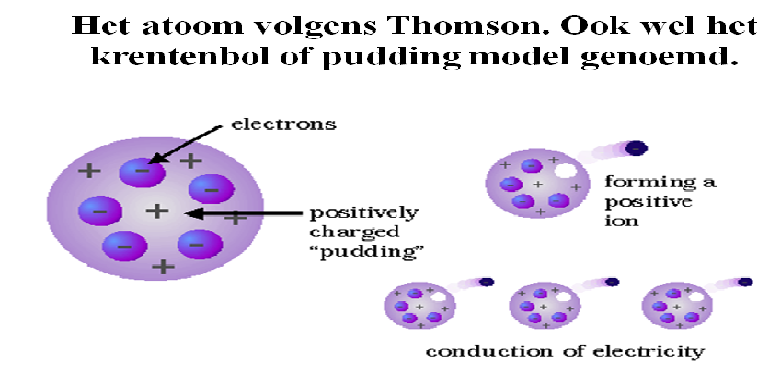
 Atoom therorie van Thomson
Atoom therorie van Thomson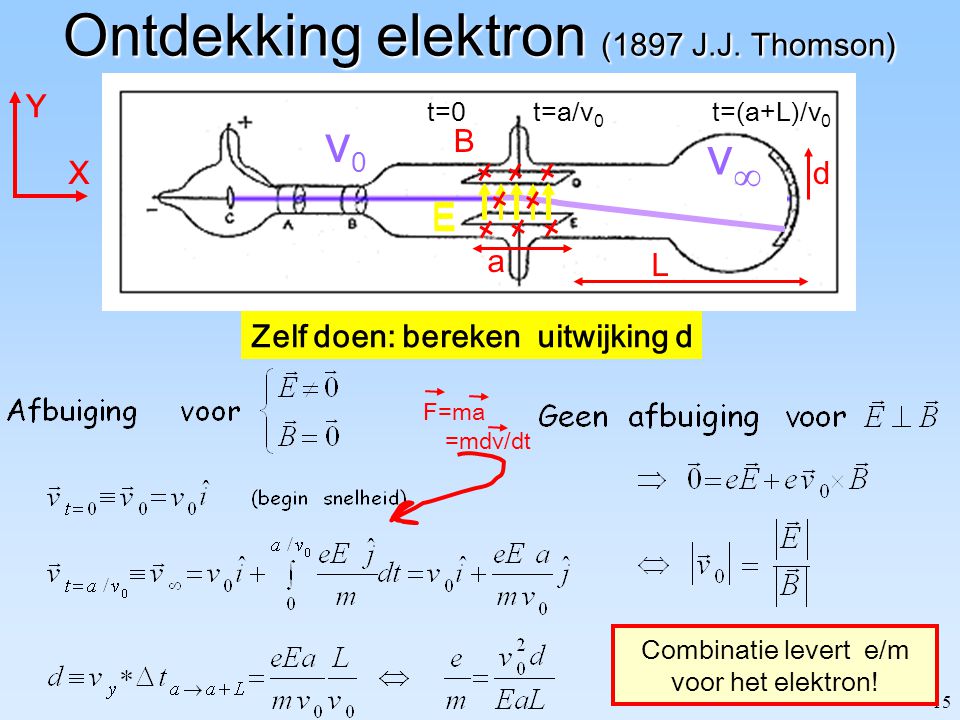
 Van Rutherford
Van Rutherford
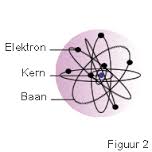
 de theorie van Bohr
de theorie van Bohr
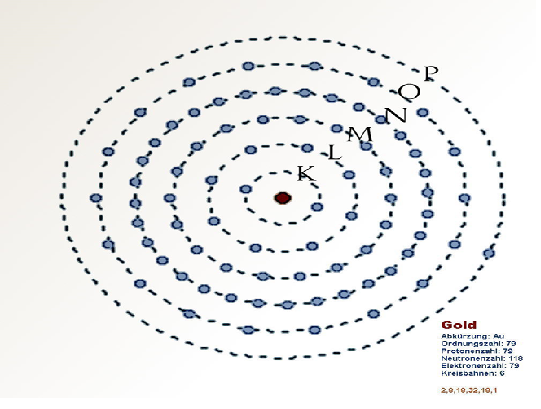
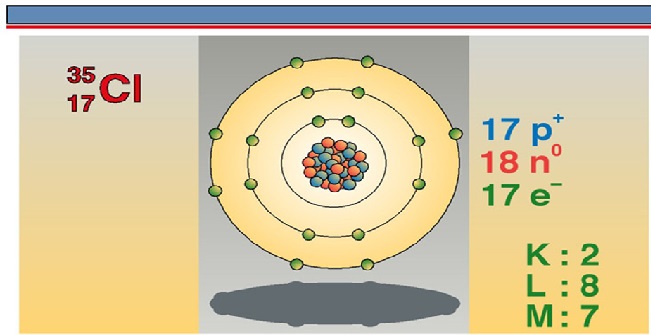

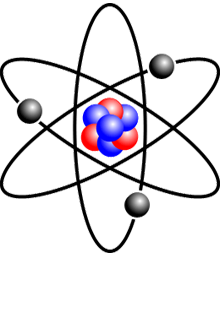
 Rutherford wilde onderzoeken hoe die negatieve lading in de goudatomen verdeeld was. Hij was geïnteresseerd in de mate waarin de alfadeeltjes afweken van hun koers. Dit zou iets kunnen zeggen over de verdeling van de lading binnen een atoom. Omdat alfadeeltjes relatief zware deeltjes zijn, die bovendien met hoge snelheid op het dunne goudfolie afgeschoten werden, verwachtte Rutherford hooguit hele kleine afwijkingen te meten.
Rutherford wilde onderzoeken hoe die negatieve lading in de goudatomen verdeeld was. Hij was geïnteresseerd in de mate waarin de alfadeeltjes afweken van hun koers. Dit zou iets kunnen zeggen over de verdeling van de lading binnen een atoom. Omdat alfadeeltjes relatief zware deeltjes zijn, die bovendien met hoge snelheid op het dunne goudfolie afgeschoten werden, verwachtte Rutherford hooguit hele kleine afwijkingen te meten.