Het arrangement Thema: Chemie om ons heen hv3 is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 21-01-2025 19:45:22
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 4.0 Internationale licentie.
Colofon
De module Chemie om ons heen is ontwikkeld door medewerkers van StudioVO.
Fair Use
In de Stercollecties van StudioVO wordt gebruik gemaakt van beeld- en filmmateriaal dat beschikbaar is op het internet. Bij het gebruik zijn we uitgegaan van fair use.
Meer informatie: Fair use .
Mocht u vragen/opmerkingen hebben,
neem dan contact op via de helpdesk VO-Content .
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Dit thema valt onder de arrangeerbare leerlijn van de Stercollecties voor scheikunde voor havo/vwo leerjaar 3. De volgende onderdelen worden behandeld: Zuivere stof en mengsel Atoom en molecuul Suspensie, oplossing, verzadigde oplossing en emulsie Hydrofoob en hydrofiel Troebele en heldere vloeistof Stofeigenschappen als kleur, geur, smaak, oplosbaarheid, brandbaarheid en fase Smeltpunt en smelttraject Reagens Dichtheid, concentratie en massapercentage Faseovergang Significante cijfers en machten van tien
- Leerniveau
- HAVO 3; VWO 3;
- Leerinhoud en doelen
- Zuren en basen; Energie; Scheikunde; Systeemdenken (scheikunde); Reactiviteit; Zuivere stoffen en mengsels; Verbranding;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 11 uur 30 minuten
- Trefwoorden
- arrangeerbaar, atoom, dichtheid, havo/vwo 3, hydrofoob, scheikunde, smeltpunt, stercollectie, stoffen, suspensie









 Bekijk de afbeelding.
Bekijk de afbeelding.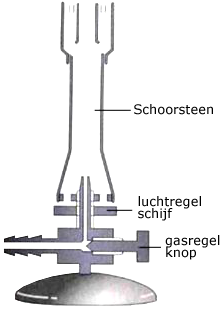 Je gaat werken met een bunsenbrander. Hiernaast staat een doorsneetekening.
Je gaat werken met een bunsenbrander. Hiernaast staat een doorsneetekening. Benodigdheden
Benodigdheden

 O5 - individueel
O5 - individueel








 De Gezondheidsraad adviseert om per dag maximaal 6 gram zout te consumeren. In de praktijk blijkt dat we dagelijks 9 tot 11 gram zout binnen krijgen.
De Gezondheidsraad adviseert om per dag maximaal 6 gram zout te consumeren. In de praktijk blijkt dat we dagelijks 9 tot 11 gram zout binnen krijgen. Flamberen heeft tot doel de alcohol te verbranden.
Flamberen heeft tot doel de alcohol te verbranden. Geen enkel kledingstuk is onbrandbaar, behalve speciale kleding van bijvoorbeeld de brandweer.
Geen enkel kledingstuk is onbrandbaar, behalve speciale kleding van bijvoorbeeld de brandweer. Op het internet zijn er allerlei tips te vinden die een kaars langer laten branden. Zo wordt er beweert dat kaarsen die druipen, korter branden dan kaarsen die niet druipen.
Op het internet zijn er allerlei tips te vinden die een kaars langer laten branden. Zo wordt er beweert dat kaarsen die druipen, korter branden dan kaarsen die niet druipen.






