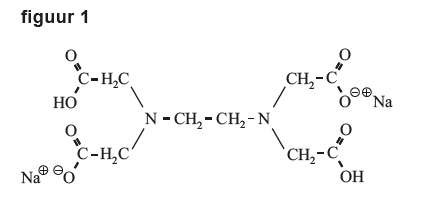
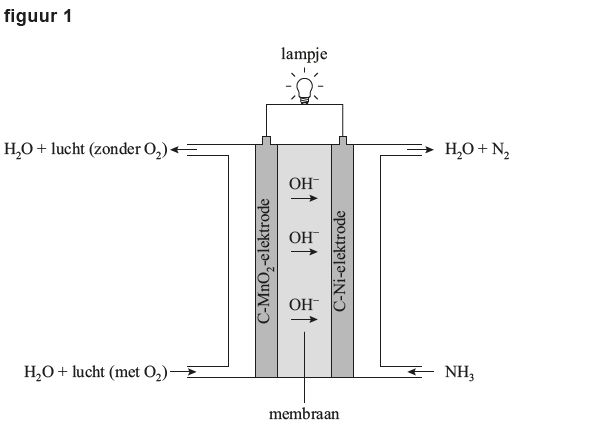
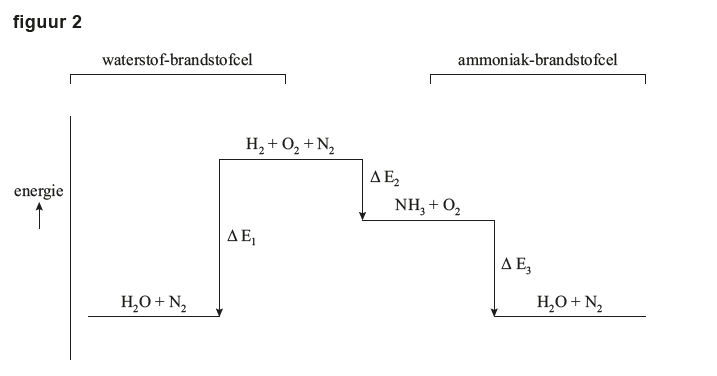
Het arrangement Examen Scheikunde Havo 2024 2e tijdvak met video-uitleg is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 02-07-2024 11:23:39
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 4.0 Internationale licentie.
Dick Naafs heeft het arrangement met de vragen en antwoorden gemaakt. Wouter Renkema heeft alleen de video-uitleg erbij geplaatst.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Het havo eindexamen scheikunde 2e tijdvak 2024 is verwerkt in een arrangement. Bij de beantwoording van de vragen is gebruik gemaakt van het correctievoorschrift van de CEVO.
- Leerniveau
- HAVO 5;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 3 uur 0 minuten
- Trefwoorden
- 2024, examen, havo, opgaven, samenvatting, scheikunde, uitleg
Bronnen
| Bron | Type |
|---|---|
|
uitlegfilmpje https://youtu.be/EQupbQc9iDk |
Video |
|
uitlegfilmpje https://youtu.be/EQupbQc9iDk |
Video |
|
uitlegfilmpje https://youtu.be/EQupbQc9iDk |
Video |
|
uitlegfilmpje https://youtu.be/EQupbQc9iDk |
Video |
|
video-uitleg https://youtu.be/EQupbQc9iDk |
Video |
|
videosamenvatting alle leerstof havo eindexamen scheikunde https://youtu.be/1-DfCJPAHDQ |
Video |
Gebruikte Wikiwijs Arrangementen
Naafs, Dick. (2024).
Examen Scheikunde Havo 2024 2e tijdvak
https://maken.wikiwijs.nl/206922/Examen_Scheikunde_Havo_2024_2e_tijdvak