Het arrangement M&N - Oplossen met water? is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 07-06-2023 13:34:44
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 4.0 Internationale licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
- Over waterdeeltjes & temperatuur
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 4 uur 0 minuten
- Trefwoorden
- aardrijkskunde, biologie, natuurkunde, scheikunde
Bronnen
| Bron | Type |
|---|---|
|
https://www.youtube.com/watch?v=RBLLanhErVw https://www.youtube.com/watch?v=RBLLanhErVw |
Video |
|
Bekijk video https://youtu.be/RM5yXMk-xH4 |
Link |
|
Bekijk de internetsite https://wikikids.nl/Celsius |
Link |
|
water en haar fases (1) - leren via filmpje https://www.youtube.com/watch?v=QdA7_RW26Zo |
Video |
|
water en haar fases (2) - leren via filmpje https://www.youtube.com/watch?v=NETdmLe3URY |
Video |
|
Link naar PHET simulatie, klik op 'Toestanden' voor de juiste versie https://phet.colorado.edu/sims/html/states-of-matter/latest/states-of-matter_nl.html |
Link |
|
https://www.youtube.com/watch?v=h4VKIDBlxVA https://www.youtube.com/watch?v=h4VKIDBlxVA |
Video |
|
Het volume berekenen van een regelmatig voorwerp https://www.youtube.com/watch?v=u7EazJLf9V4 |
Video |
|
kennisclip dichtheid berekenen van een onregelmatig voorwerp https://youtu.be/LFaa3qg9HpA |
Video |
|
https://player.ntr.nl/index.php?id=WO_NTR_427047 https://player.ntr.nl/index.php?id=WO_NTR_427047 |
Video |
|
https://player.ntr.nl/index.php?id=WO_NTR_428473 https://player.ntr.nl/index.php?id=WO_NTR_428473 |
Video |
|
Informatie over rivieren https://maken.wikiwijs.nl/87259#!page-2511715 |
Link |
Gebruikte Wikiwijs Arrangementen
Herbert Vissers eXplore. (2022).
M&M - Marketing - Communiceren
https://maken.wikiwijs.nl/193248/M_M___Marketing___Communiceren
Herbert Vissers eXplore. (2023).
M&N - F around and find out (onderzoek doen bij biologie)
https://maken.wikiwijs.nl/196463/M_N___F_around_and_find_out__onderzoek_doen_bij_biologie_
Letimi. (2019).
Water, Deeltjes & Temperatuur
https://maken.wikiwijs.nl/143483/Water__Deeltjes___Temperatuur




 Egodact met de titel van deze quest en het aantal XM dat erbij hoort.
Egodact met de titel van deze quest en het aantal XM dat erbij hoort. Seesaw.
Seesaw.





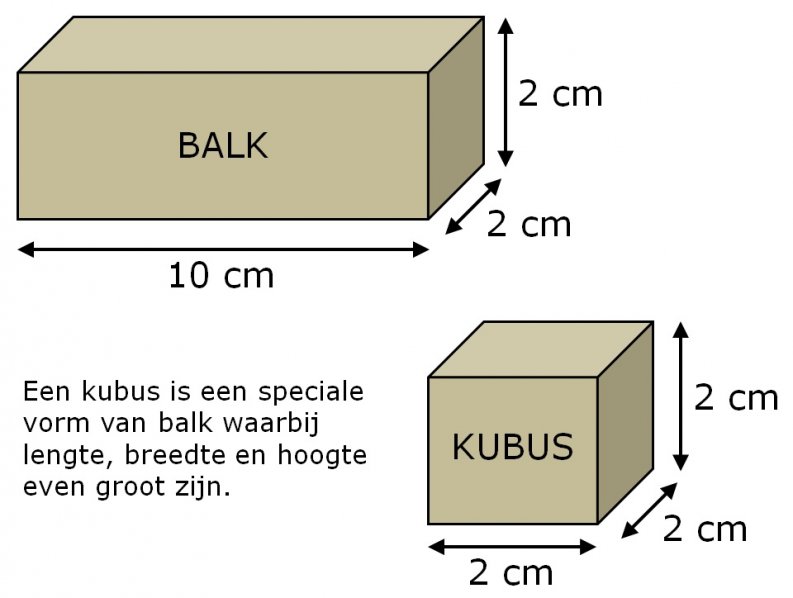
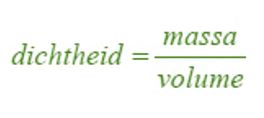 of in symbolen
of in symbolen 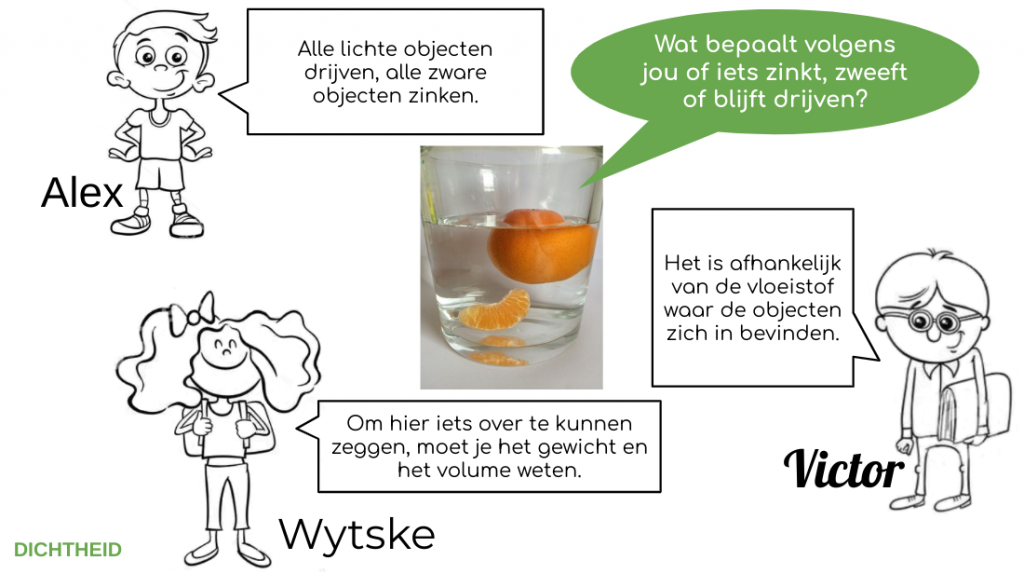


 Reflective journal
Reflective journal