Het arrangement Zuurbasenevenwichten is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 03-02-2022 14:31:45
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 4.0 Internationale licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 4.0 Internationale licentie.
Deze les werd gemaakt tijdens het blended learning van 2020-2021 voor de zuurbasenreacties.
De leerlingen kunnen deze les tijdens het afstandsleren gebruiken om begrippen te herhalen, oefeningen te maken, de leerstof in te studeren.
wanneer de wereld verlost is van Covid-19 zal deze les gebruikt worden om differentiatie in het les geven toe te laten. Leerlingen bereiden een gedeelte voor, de leerlingen die alles begrepen hebben kunnen verdiepende oefeningen oplossen. De leerlingen die meer uitleg willen vragen volgen de les op school.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 4 uur 0 minuten
Bronnen
| Bron | Type |
|---|---|
|
Sulfonium https://pubchem.ncbi.nlm.nih.gov/compound/Sulfonium#section=2D-Structure |
Link |
|
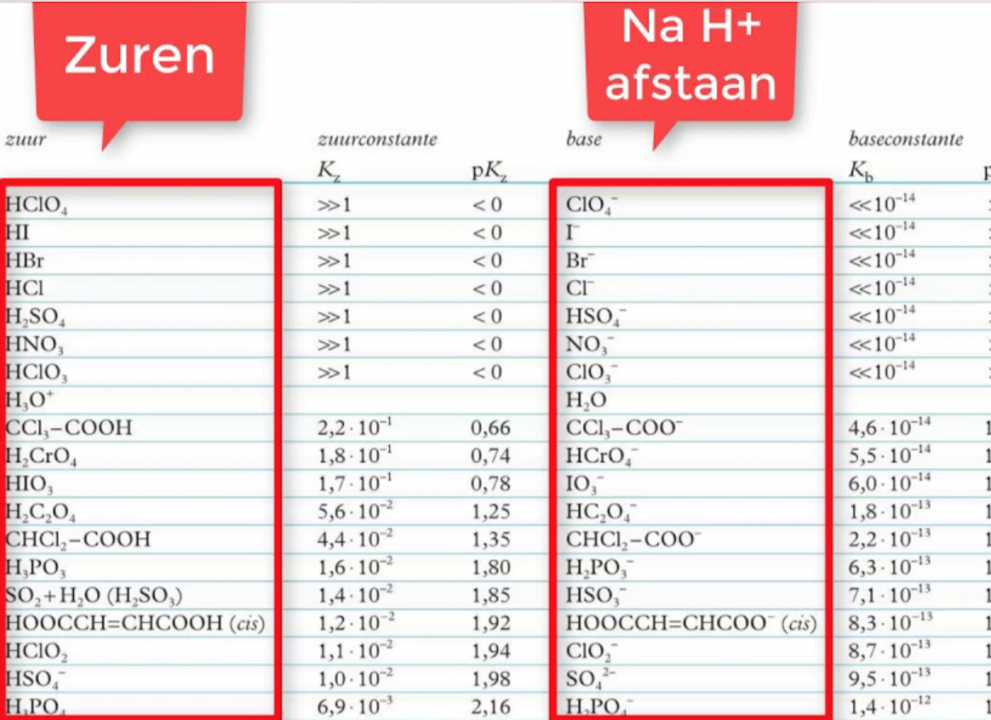
Kz van enkele zuren https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Reference/Reference_Tables/Equilibrium_Constants/E1%3A_Acid_Dissociation_Constants_at_25C |
Link |
|
Herhaling begrippen zuur, base, amfoliet, geconjugeerd, ka,.... https://youtu.be/Xeuyc55LqiY |
Video |
|
Wat is pH? Belang voor o.a. biologie. https://youtu.be/Xeuyc55LqiY |
Video |