Het arrangement Chemische reacties is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 20-01-2023 15:02:44
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding 3.0 Nederlands licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
Bronnen
| Bron | Type |
|---|---|
|
https://www.youtube.com/watch?v=Dz5ncySeZ4w https://www.youtube.com/watch?v=Dz5ncySeZ4w |
Link |
|
https://www.snapput.nl/video/ontledingsreacties/ https://www.snapput.nl/video/ontledingsreacties/ |
Link |
|
verbinding en element https://wetenschap.infonu.nl/scheikunde/50674-elementen-verbindingen-zuivere-stoffen-en-mengels.html |
Link |
|
https://www.youtube.com/watch?v=uCC2SWgbEQM https://www.youtube.com/watch?v=uCC2SWgbEQM |
Link |
|
https://www.youtube.com/watch?v=4vc1msUruzw https://www.youtube.com/watch?v=4vc1msUruzw |
Link |
|
wat zijn moleculen? https://www.youtube.com/watch?v=RBLLanhErVw |
Link |
|
molecuulmodel http://www.inask.nl/index.php/13-Onderwerpen/Materialen/80-Het-Molecuulmodel |
Link |

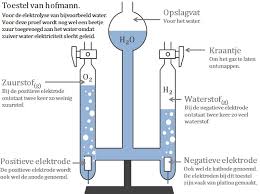

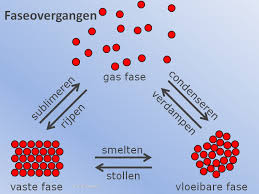

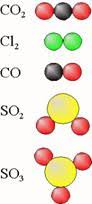
 Sommige lagen steenkool liggen zo diep in de bodem dat het economisch niet rendabel is om die met mijnbouw te winnen. Met het proces van 'kolenvergassing' is dat wel te doen. Men brengt via pijpen hete stoom in de steenkoollagen. Daar reageert de hete stoom met koolstof waarbij 'watergas' ontstaat. Dit is een mengsel van de gassen waterstof en koolstofmonooxide. Een deel van dit proces staat in het figuur hiernaast afgebeeld.
Sommige lagen steenkool liggen zo diep in de bodem dat het economisch niet rendabel is om die met mijnbouw te winnen. Met het proces van 'kolenvergassing' is dat wel te doen. Men brengt via pijpen hete stoom in de steenkoollagen. Daar reageert de hete stoom met koolstof waarbij 'watergas' ontstaat. Dit is een mengsel van de gassen waterstof en koolstofmonooxide. Een deel van dit proces staat in het figuur hiernaast afgebeeld.