Het arrangement Sk-03 Fasen en fase-overgangen - kopie 1 is gemaakt met Wikiwijs van Kennisnet. Wikiwijs is hét onderwijsplatform waar je leermiddelen zoekt, maakt en deelt.
- Auteur
- Laatst gewijzigd
- 15-12-2025 21:11:15
- Licentie
-
Dit lesmateriaal is gepubliceerd onder de Creative Commons Naamsvermelding-GelijkDelen 3.0 Nederland licentie. Dit houdt in dat je onder de voorwaarde van naamsvermelding en publicatie onder dezelfde licentie vrij bent om:
- het werk te delen - te kopiëren, te verspreiden en door te geven via elk medium of bestandsformaat
- het werk te bewerken - te remixen, te veranderen en afgeleide werken te maken
- voor alle doeleinden, inclusief commerciële doeleinden.
Meer informatie over de CC Naamsvermelding-GelijkDelen 3.0 Nederland licentie.
Aanvullende informatie over dit lesmateriaal
Van dit lesmateriaal is de volgende aanvullende informatie beschikbaar:
- Toelichting
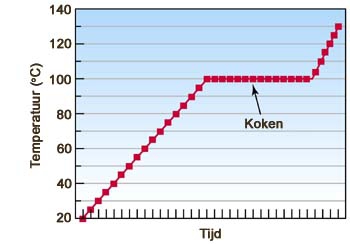
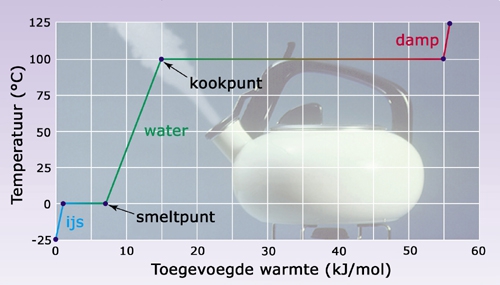
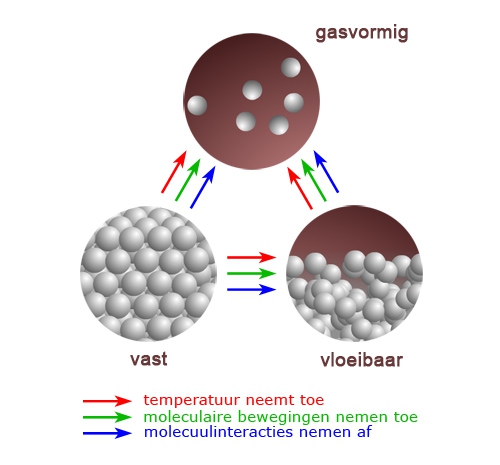
- Vakinhoudelijk deel van een thema over fasen en fase-overgangen, omgezet in een Wikiwijs arrangement vanuit een prototype van een kennisbank scheikunde van het voormalige Ruud de Moor Centrum van de OU; zie ook de colofon in het arrangement voor toelichting. Samenvatting: De toestand waarin een stof voorkomt noemen we de fase of aggregatietoestand. Afhankelijk van temperatuur en druk treden er overgangen op van de ene naar de andere fase. Deze overgangen kunnen we beschrijven op twee niveaus, op macroscopisch niveau (waarneembare, fysische verschijnselen) en op microscopisch niveau (beschouwing op moleculair niveau, verklaarbaar met de molecuultheorie).
- Leerniveau
- VMBO gemengde leerweg, 2; VMBO kaderberoepsgerichte leerweg, 1; VWO 2; VO; VMBO kaderberoepsgerichte leerweg, 2; VMBO basisberoepsgerichte leerweg, 4; VMBO gemengde leerweg, 3; VMBO basisberoepsgerichte leerweg, 1; VMBO theoretische leerweg, 1; HAVO 4; HAVO 1; VMBO theoretische leerweg, 4; VWO 6; VMBO gemengde leerweg, 1; VMBO theoretische leerweg, 2; VMBO basisberoepsgerichte leerweg, 2; HAVO; VWO 1; VWO; HAVO 3; VWO 3; VMBO; HAVO 5; VWO 4; VMBO theoretische leerweg, 3; VMBO basisberoepsgerichte leerweg, 3; VMBO kaderberoepsgerichte leerweg, 4; HAVO 2; VMBO gemengde leerweg, 4; VWO 5; VMBO kaderberoepsgerichte leerweg, 3;
- Leerinhoud en doelen
- Scheikunde;
- Eindgebruiker
- leerling/student
- Moeilijkheidsgraad
- gemiddeld
- Studiebelasting
- 0 uur 50 minuten
- Trefwoorden
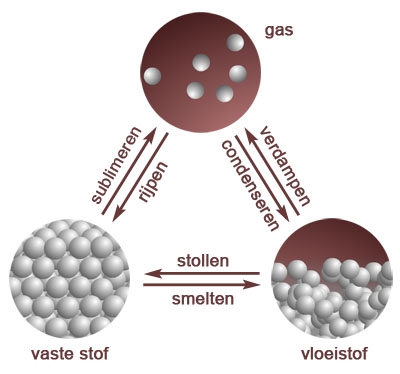
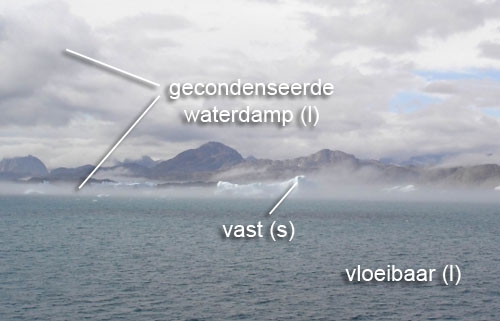
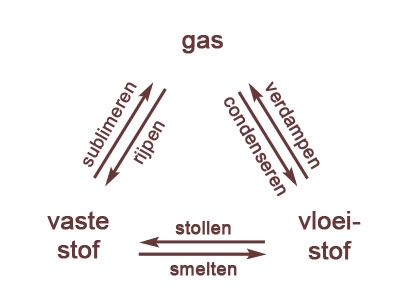
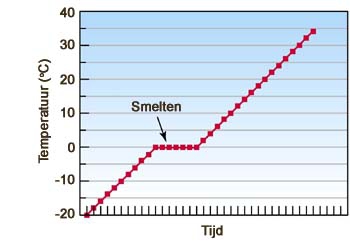
- absolute nulpunt, afkoelen, aggregatietoestand, bar, bewegingsenergie, chemie, cohesie, condenseren, damp, fase, fase-overgang, fasedriehoek, fasen, faseverandering, fysische constante, gas, gasvormig, ijs, intermoleculair, intermoleculaire krachten, kookcurve, kookdiagram, kookpunt, kookpuntsbepaling, kristalrooster, macroscopisch, microscopisch, moleculair, molecuultheorie, pascal, rijpen, scheikunde, smeltcurve, smelten, smeltpunt, smeltpuntsbepaling, standaarddruk, standaardtemperatuur, stofeigenschap, stofeigenschappen, stollen, stolpunt, sublimeren, temperatuur, vast, vaste stof, verdampen, verwarmen, vloeibaar, vloeistof, warmte, water, waterdamp, waterstofbrug
Bronnen
| Bron | Type |
|---|---|
|
https://youtu.be/V0hV4BN2Kgk https://youtu.be/V0hV4BN2Kgk |
Video |
|
Van vaste stof naar gasvorming en weer terug naar vaste stof https://www.schooltv.nl/beeldbank/embedded.jsp?clip=20110212_sublimeren01 |
Video |
|
Waarom zijn takjes van bomen bij vriesweer zo mooi wit? https://www.schooltv.nl/beeldbank/embedded.jsp?clip=20031208_09_04rijpen |
Video |
Gebruikte Wikiwijs Arrangementen
Kroonen, Ed. (2017).
Sk-03 Fasen en fase-overgangen3
https://maken.wikiwijs.nl/112994/Sk_03_Fasen_en_fase_overgangen3